288: ビタミン(Vitamins)
健康的な食事には、細胞を正常に成長させるために必要な栄養素がすべて含まれていなければならない。これにはタンパク質(protein)、核酸(nucleic acid)、炭水化物(carbohydrate)、脂肪(fat)が含まれ、これらはすべて分解されて私たち自身の分子を作り、生きるために必要なエネルギーを供給するために使われる。私たちは、血液中のヘモグロビン(hemoglobin)に必要となる鉄分や骨を作るカルシウムなど、多くのミネラルが必要である。また、13種類の必須ビタミンも少量必要である。ビタミンは小さく珍しい分子で、私たちの細胞の中で重要な仕事を行うのに使われている。これらの分子は健康な生活に必要だが、私たちの細胞は作ることができない。そのため、食事やサプリメントから摂取する必要がある。
ビタミンの進化
ここで一つの疑問が生じる。もしこれらの分子がそれほど重要なら、なぜ私たちはそれを作ることができないのだろうか? その答えは、生物学に関連する多くの事柄と同様、進化に見出すことができる。私たちの遠い祖先が進化する過程で、これらの分子は一般的な食事から自由に入手できたため、ゼロから作らなければならないという強いプレッシャーはなかった。また、これらの分子の多くは化学的につくるのが難しいため、それらの構築に資源を費やすことに対して選択圧がかかる。つまり、私たちの遠い家系のどこかで、分子を作れるという安心感がコストに見合わなくなり、分子を作る能力は永遠に失われたのである。
自殺酵素
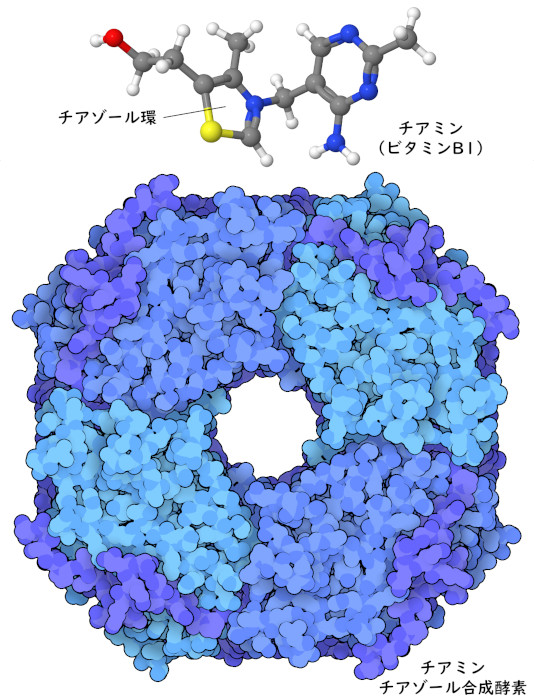
ビタミンB1(チアミン)(vitamin B1 (thiamine))を作る酵素は、この進化のトレードオフに関する良い一例である。植物や酵母の細胞では、珍しいチアゾール環(thiazole ring)はチアミン・チアゾール合成酵素(thiamine thiazole synthase)という酵素によって作られる。研究者たちがこの酵素の構造(PDB ID 3fpz)を調べたところ、鎖の中にあるシステインアミノ酸のうち、205番目の位置にある1つが硫黄原子を欠いていることがわかった。さらに研究を進めると、この酵素は反応中にこの硫黄原子を提供し、チアゾール環を構築するのに利用していることがわかった。だから、チアミン・チアゾール合成酵素は一度しか働くことができない「自殺酵素」なのである。このため、チアミンを作るには非常にコストがかかり、酵母細胞はこのタンパク質を大量に作らなければならない。私たち(や他の動物たち)はチアミンをたくさん含む植物を食べているので、この一回しか使えない酵素を構築し自分でチアミンをつくるというコストを負担する必要はない。
致命的な結果
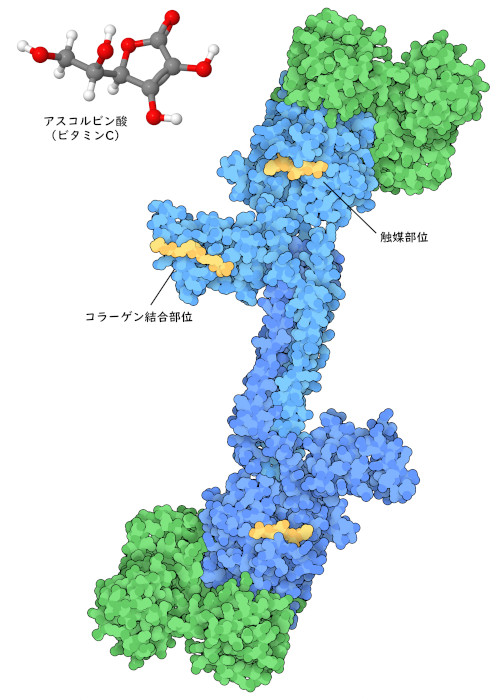
ビタミンは、その分子の供給源が食生活にないときに起きる歴史的な病気との関連で発見された。例えば、何世紀も前、長い航海に出た船乗りは、コラーゲン(collagen)をつくることができないことによって起きる病気の一つである壊血病(scurvy)にかかった。その原因は、食事中にビタミンC(アスコルビン酸)(vitamin C (ascorbic acid))が不足していることであり、最終的には柑橘類をたくさん詰め込んで航海することにより解決した。今日、私たちはこの病気になったとき、分子レベルでどんなことが起きているのかについて詳細を見ることができる。コラーゲンプロリル4-ヒドロキシラーゼ(collagen prolyl 4-hydroxylase)という酵素(ここに示すのはPDBエントリー7zscと4btaの構造)は、プロリン(proline)をヒドロキシプロリン(hydroxyproline)に変換するが、これは健康な結合組織のコラーゲン線維において密なパッキングと相互作用をするのに欠かせない。この反応を行うとき、この酵素は鉄-硫黄クラスター(iron-sulfur cluster)を使うが、不要な副反応によってクラスターが不活性化されることがある。ここで登場するのがビタミンCである。ビタミンCは強力な抗酸化物質で、鉄原子を適切な酸化状態に回復させ、酵素を復活させる。
ニンジンを食べよう!
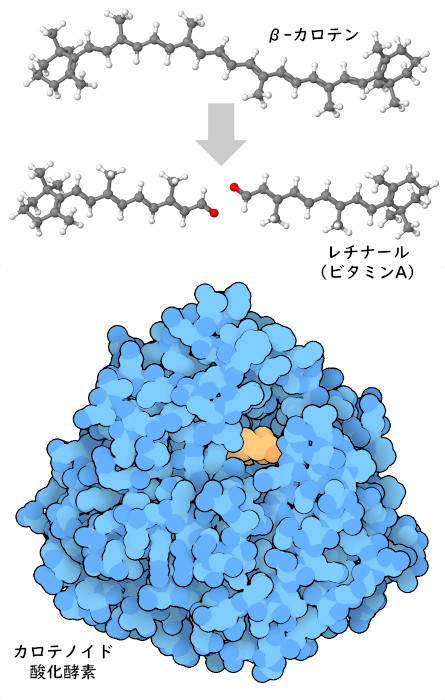
私たちはビタミンのほとんどを食品から摂取しているが、現代社会では多くの加工食品でビタミンが強化されており、それによっていつでも十分な量を摂ることができる。多くの場合、私たちは食品から直接ビタミンを摂取する。なぜなら、私たちが食べる植物や動物は、それら自身の細胞内において私たちと同じようにビタミンを使っているからである。また、別の機能に使われる分子からビタミンを作り出す場合もある。例えば、植物にはカラフルなβ-カロテン(beta-carotene)という分子があり、特定の波長の光を吸収するため、鮮やかな色をしている。ニンジンは典型的なβ-カロテンの供給源であり、この成分がニンジンをオレンジ色にしている。私たちの細胞は、カロテンオキシゲナーゼ(carotene oxygenase)という酵素を使ってβ-カロテンを2つに分割し、それぞれが機能するビタミンA(レチナール)(vitamin A (retinal))の分子となる。レチナールもまた光を吸収するが、私たちの目では受容体タンパク質のロドプシン(rhodopsin)で使われている。シアノバクテリアに由来し、レチナールをつくる酵素に似ているタンパク質(PDBエントリー2biw)をここに示す。また、ヒトの酵素を予測したモデルをAF_AFQ9HAY6F1で見ることができる。
取引の技
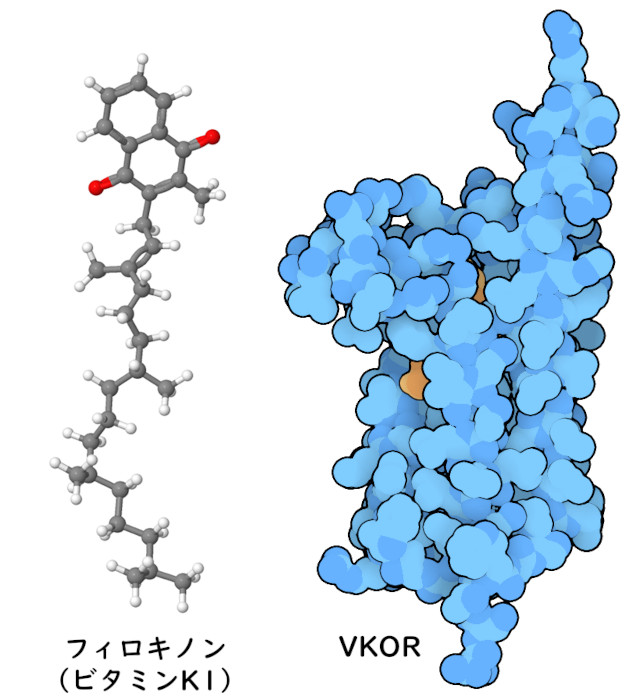
ビタミンには有用な化学的特性がある。ビタミンAは特定の目的に特化した物質で、私たちの目で光を感知する。ビタミンB群は汎用的な役割を持っていて、化学基(または単電子)を必要な場所に届けることに優れており、さまざまな酵素に利用される。ビタミンCとビタミンEは私たちの分子を損傷から守る抗酸化物質であり、ビタミンDはメッセージを伝えるホルモンとして使われる。ビタミンKは、第X因子(factor X)のような血液凝固に関与するタンパク質中においてアミノ酸のグルタミン酸を修飾し、細胞表面に強く結合できるようにする酵素によって使われる。PDBエントリー6wv5の構造はこの反応を助ける酵素を示しているが、これは強力な抗凝固剤のワルファリン(warfarin)の標的である。ビタミンKはたくさんの役割を持っている。ビタミンKは、植物では非常に異なった働きをしており、「フィロキノン」(phylloquinone)という名で呼ばれる。これは、光化学系I(photosystem I)のようなタンパク質中において電子の移動を管理するのに役立っている。
道具の準備
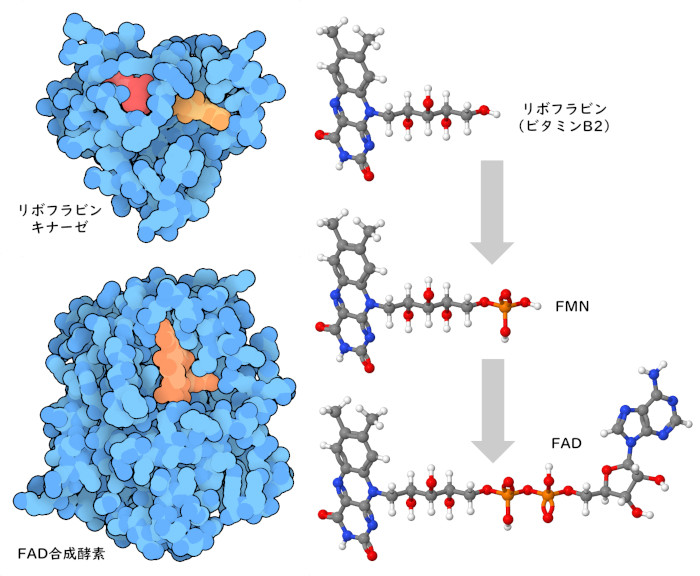
ビタミンB群は化学基や電子の運搬に使われるため、それを利用する酵素によって非常に注意深く位置決めされる必要がある。しかし、ビタミンB群のいくつかは分子が小さくて管理が難しいため、細胞はそれらに便利な化学的ハンドルを付加する。例えば、ヌクレオチドがリボフラビン(ビタミンB2)(riboflavin (vitamin B2))に付加されてFADが作られ、ナイアシン(ビタミンB3)(niacin (vitamin B3))にも同じ様なハンドルが付加されてNADができる。2つの酵素がリボフラビンを使う準備をする。まずリボフラビンキナーゼ(riboflavin kinase、PDBエントリー1p4m)がリン酸を付加し、次にFAD合成酵素(FAD synthetase、PDBエントリー2wsi)がヌクレオチドを付加する。
自分たちでやる
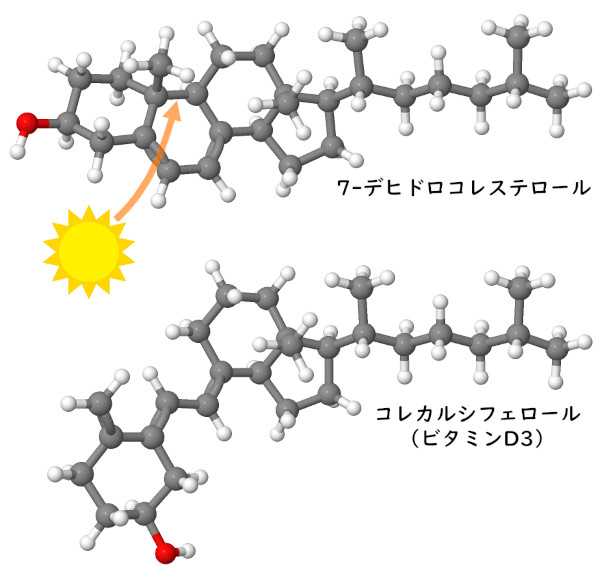
この節では、2つのビタミンを中心に話を進める。私たちの細胞はこれらのビタミンを作ることができるが、十分でないこともある。ナイアシン(ビタミンB3)は、あらゆる生合成経路やエネルギー生産経路で使われる中心的な電子運搬役であるNADHを作るのに用いられる。例えば解糖系(glycolysis)やクエン酸回路(citric acid cycle)の酵素から、巨大なNADHデヒドロゲナーゼ複合体(NADH dehydrogenase complex)へと電子を運ぶ。私たちの細胞はアミノ酸のトリプトファンからナイアシンを作ることはできるが、その過程は非効率的であるため、私たちは主に食事からの摂取に頼っている。ビタミンDは、皮膚において日光を浴びることによりコレステロールの一種が化学的に再編成されてできる。日差しの強い地域に住んでいる場合は全く問題ないが、そうでない場合は、タラ肝油やその他の栄養補助食品から摂取する必要があるかもしれない。
特別配達
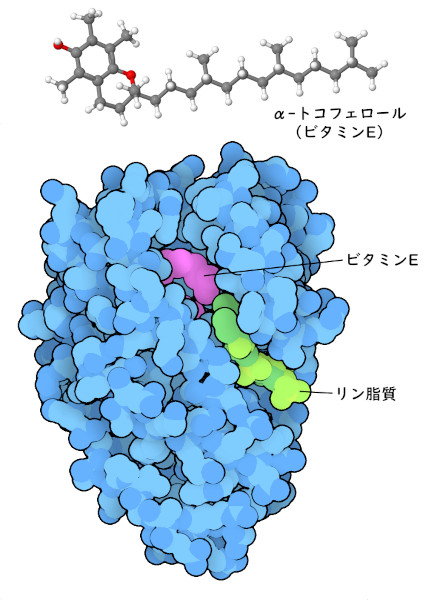
場合によって、私たちの体は、ビタミンを必要な場所に届けるために特別な努力をする必要がある。例えば、ビタミンE(トコフェロール)(vitamin E (tocopherol))は脂溶性の抗酸化物質で、私たちの細胞膜を保護している。これは水にあまり溶けないため、私たちはトコフェロール運搬タンパク質を作り、血流を通じて必要な場所に届けている。このタンパク質の構造(PDBエントリー3w67)を見ると、ビタミンはタンパク質の内部で保護されているが、標的細胞に到達すると、近くの溝にある脂質が結合してタンパク質を開き、ビタミンを放出することができる。
構造をみる
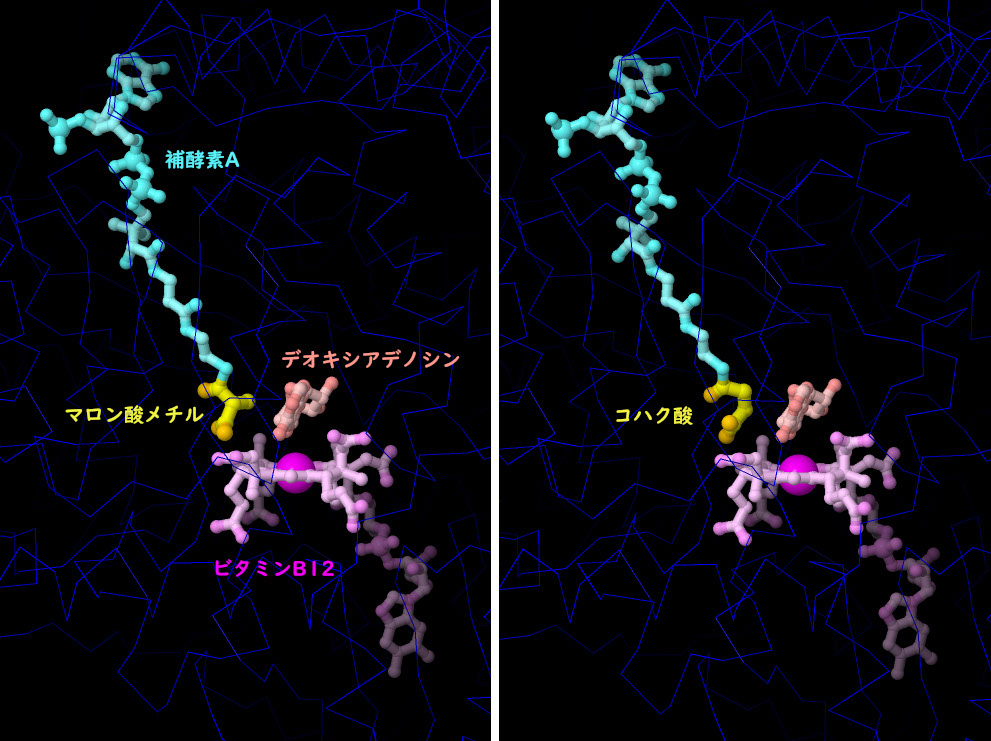
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
最も大きいビタミンであるビタミンB12(コバラミン)(vitamin B12 (cobalamin))を利用するのは、私たちの細胞の中でもごく一部の酵素だけである。ここに示すのは、メチルマロニル補酵素Aムターゼ(methylmalonyl coenzyme A mutase、PDBエントリー4req)で、炭素原子を取り除き、わずかに異なる場所に置き換えることによって、マロン酸メチル(methylmalonate)とコハク酸(succinate)を相互に変換する。反応中、ビタミンB5を使って作られる分子が、補因子の補酵素AによりビタミンB12の近くで保持される。これは、アミノ酸を分解し、クエン酸回路の燃料となるコハク酸に変換する過程における重要な段階である。この構造には両方の状態の分子が含まれている。この反応は、ビタミンB12の中心にあるコバルト原子が、近くにある分子デオキシアデノシン(deoxyadenosine)の助けを借りて行う。図の下にあるボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳しく調べてみてほしい。
理解を深めるためのトピックス
- PDBアーカイブに登録されている構造の多くにビタミン分子が含まれている。ビタミンのPDBj化合物ページにアクセスし、「関連するPDBエントリー」タブを見ると、その分子を含むPDBエントリーを見つけることができる。例えば、このビタミンB12のページを確認すると、現在100以上のエントリーに含まれていることがわかる。
- ビタミンの供給源と健康効果に関する詳しい情報は、米国国立医学図書館のページ(英語)を参照のこと。
参考文献
- 7zsc 2022 Crystal structure of the collagen prolyl 4-hydroxylase (C-P4H) catalytic domain complexed with PDI: Toward a model of the C-P4H alpha 2 beta 2 tetramer. J Biol Chem 298 102614-102614
- 6wv5 2021 Structural basis of antagonizing the vitamin K catalytic cycle for anticoagulation. Science 371 eabc5667
- 4bta 2013 The structural motifs for substrate binding and dimerization of the alpha subunit of collagen prolyl 4-hydroxylase. Structure 21 2107-2118
- 2013 Widespread decay of vitamin-related pathways: coincidence or consequence? Trends Genetics 29 469-478
- 3w67 2013 Impaired alpha-TTP-PIPs interaction underlies familial vitamin E deficiency. Science 340 1106-1110
- 3fpz 2011 Saccharomyces cerevisiae THI4p is a suicide thiamine thiazole synthase. Nature 478 542-546
- 2wsi 2010 Crystal structure of yeast FAD synthetase (Fad1) in Complex with Fad. J Mol Biol 398 641-646
- 2biw 2005 The structure of a retinal-forming carotenoid oxygenase. Science 308 267-269
- 1p4m 2003 Crystal structure of human riboflavin kinase reveals a beta barrel fold and a novel active site arch. Structure 11 265-273
- 4req 1998 Conformational changes on substrate binding to methylmalonyl CoA mutase and new insights into the free radical mechanism. Structure 6 711-720
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト