288: 비타민 (Vitamins)
건강한 식사에는 세포를 정상적으로 성장시키는 데 필요한 영양소가 모두 포함되어 있어야 한다. 여기에는 단백질(protein), 핵산(nucleic acid), 탄수화물(carbohydrate), 지방(fat)이 포함되며, 이들은 모두 분해되어 우리 자신의 분자를 만들고 살기 위해 필요한 에너지를 공급하는 데 쓰인다. 우리는 혈액 속 헤모글로빈(hemoglobin)에 필요한 철분과 뼈를 만드는 칼슘 등 많은 미네랄이 필요하다. 또한 13종류의 필수 비타민도 소량 필요하다. 비타민은 작고 희귀한 분자로 우리 세포 안에서 중요한 일을 하는 데 사용된다. 이 분자들은 건강한 생활에 필요하지만 우리 세포는 만들 수 없다. 따라서 식사나 영양제로부터 섭취할 필요가 있다.
비타민의 진화
여기서 한 가지 의문이 생긴다. 만약 이 분자들이 그렇게 중요하다면 왜 우리는 그것을 만들 수 없을까? 그 답은 생물학과 관련된 많은 것들과 마찬가지로 진화에서 찾을 수 있다. 우리의 먼 조상들이 진화하는 과정에서 이 분자들은 일반적인 식사에서 자유롭게 구할 수 있었기 때문에 처음부터 만들어야 한다는 강한 압박감은 없었다. 또한 이 분자들의 대부분은 화학적으로 만들기 어렵기 때문에 그러한 것을 만드는 데 자원을 소비하는 것에 대해 선택압(選擇壓)이 걸린다. 즉, 우리의 먼 가계(家系) 어딘가에서 분자 생성에 대한 비용 대비 효율이 좋지 않아서 분자를 만드는 능력이 영원히 상실된 것이다.
자살효소
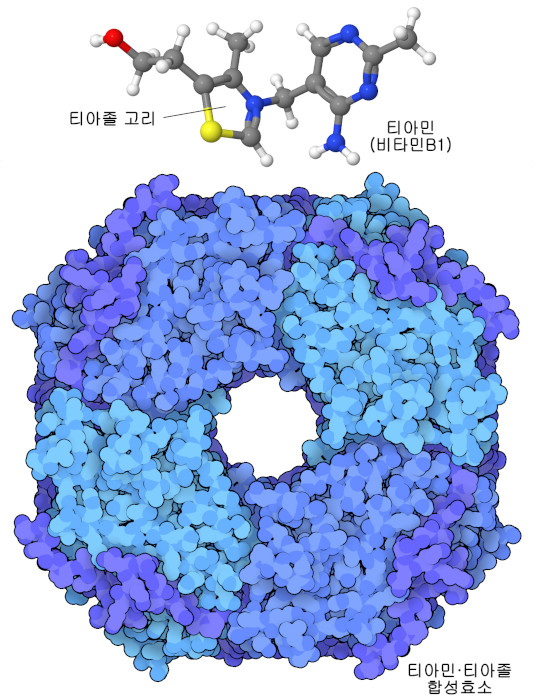
비타민 B1(티아민)(vitamin B1(thiamine))을 만드는 효소는 이 진화의 절충에 관한 좋은 예이다. 식물이나 효모의 세포에서 희귀한 티아졸 고리(thiazole ring)는 티아민·티아졸 합성효소(thiamine thiazole synthase)라는 효소에 의해 만들어진다. 연구자들이 이 효소의 구조(PDB ID 3fpz)를 조사한 결과 사슬 안에 있는 시스테인 아미노산 중 205번째 위치에 있는 1개에 유황 원자가 빠진 것을 알았다. 연구를 더 진행하자 이 효소는 반응 중 이 유황 원자를 제공해 티아졸 고리를 구축하는 데 이용하고 있는 것을 알았다. 그래서 티아민·티아졸 합성효소는 한 번밖에 작용할 수 없는 ‘자살효소’인 것이다. 이 때문에 티아민을 만드는 데는 비용이 많이 들고 효모 세포는 이 단백질을 대량으로 만들어야 한다. 우리(또는 다른 동물들)는 티아민을 많이 함유한 식물을 먹고 있기 때문에 이 한 번밖에 사용할 수 없는 효소를 구축해 스스로 티아민을 만드는 비용을 부담할 필요가 없다.
치명적인 결과
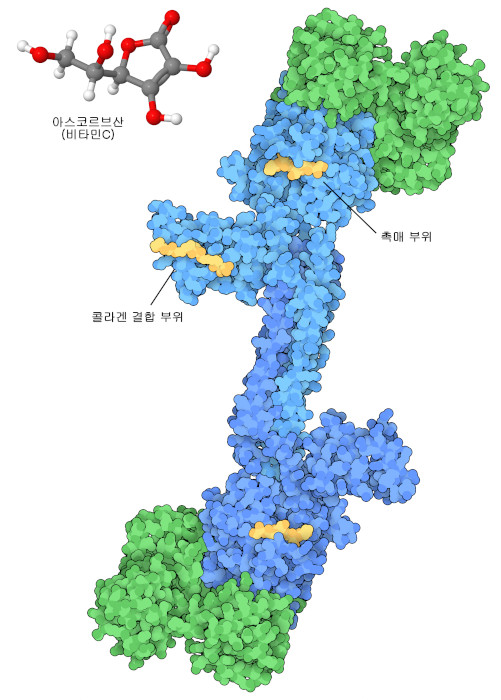
비타민은 그 분자의 공급원이 식생활에 없을 때 일어나는 역사적인 질병과의 관련으로 발견되었다. 예를 들어 수 세기 전, 긴 항해에 나선 뱃사람은 콜라겐(collagen)을 만들지 못해 생기는 병 중 하나인 괴혈병(scurvy)에 걸렸다. 그 원인은 식사 안에 비타민 C(아스코르브산)(vitamin C(ascorbic acid))가 부족한 것이었으며 최종적으로는 감귤류를 많이 채워 항해함으로써 해결되었다. 오늘날 우리는 이 병에 걸렸을 때 분자 수준에서 어떤 일이 일어나고 있는지에 대해 자세히 볼 수 있다. 콜라겐 프롤릴 4-하이드록시라아제(collagen prolyl 4-hydroxylase)라는 효소(여기에 나타낸 것은 PDB 엔트리 7zsc와 4bta의 구조)는 프롤린(proline)을 하이드록시프롤린(hydroxyproline)으로 변환하는데, 이는 건강한 결합조직의 콜라겐 섬유에서 긴밀한 패킹과 상호 작용을 하는 데 필수적이다. 이 반응을 수행할 때 이 효소는 철-유황 클러스터(iron-sulfur cluster)를 사용하지만 불필요한 부반응으로 인해 클러스터가 불활성화될 수 있다. 여기서 등장하는 것이 비타민 C다. 비타민 C는 강력한 항산화 물질로 철 원자를 적절한 산화 상태로 회복시켜 효소를 부활시킨다.
당근을 먹자!
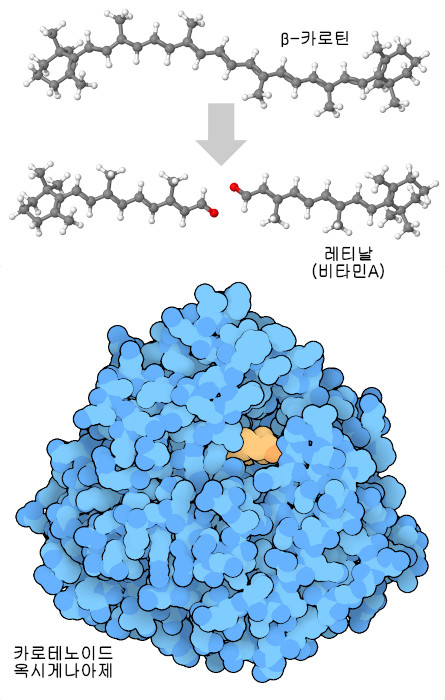
우리는 비타민의 대부분을 식품에서 섭취하고 있지만 현대 사회에서는 많은 가공식품에서 비타민이 강화되고 있으며, 그로 인해 언제든지 충분한 양을 섭취할 수 있다. 대부분의 경우 우리는 식품에서 직접 비타민을 섭취한다. 왜냐하면 우리가 먹는 식물이나 동물들은 그들 자신의 세포 내에서 우리와 마찬가지로 비타민을 사용하기 때문이다. 또한 다른 기능에 사용되는 분자에서 비타민을 만들어내는 경우도 있다. 예를 들어 식물에는 알록달록한 β-카로틴(beta-carotene)이라는 분자가 있어 특정 파장의 빛을 흡수하기 때문에 선명한 색을 띠고 있다. 당근은 전형적인 β-카로틴 공급원이며, 이 성분이 당근을 주황색으로 만든다. 우리 세포는 카로틴 옥시게나아제(carotene oxygenase)라는 효소를 사용해 β-카로틴을 2개로 분할하고, 각각이 기능하는 비타민 A(레티날)(vitamin A(retinal)) 분자가 된다. 레티날 또한 빛을 흡수하지만 우리 눈에서는 수용체 단백질인 로돕신(rhodopsin)으로 쓰인다. 시아노박테리아에서 유래해 레티날을 만드는 효소와 비슷한 단백질(PDB 엔트리 2biw)을 여기에 나타낸다. 또한 인간의 효소를 예측한 모델을 AF_AFQ9HAY6F1에서 볼 수 있다.
거래 기술
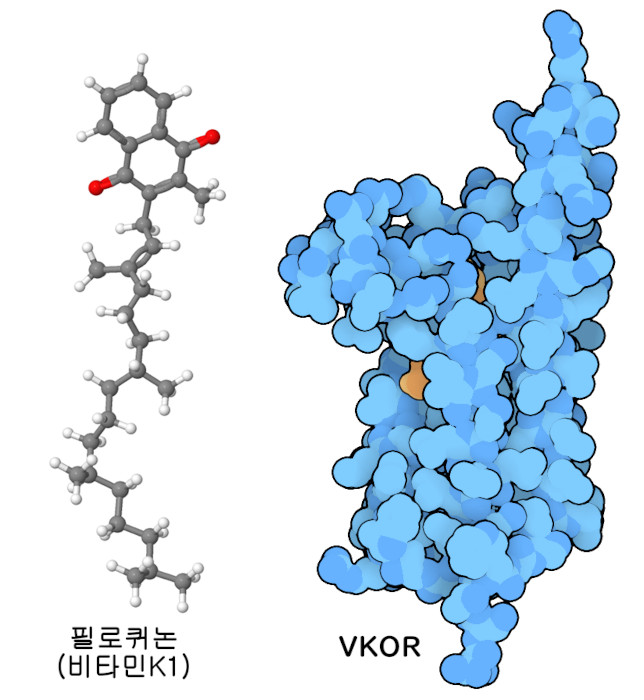
비타민에는 유용한 화학적 특성이 있다. 비타민 A는 특정 목적에 특화된 물질로 우리 눈에서 빛을 감지한다. 비타민 B군은 범용적인 역할을 하고 있어 화학기(또는 단전자)를 필요한 장소에 전달하는 데 탁월하며 다양한 효소에 이용된다. 비타민 C와 비타민 E는 우리의 분자를 손상으로부터 보호하는 항산화물질이고 비타민 D는 메시지를 전달하는 호르몬으로 쓰인다. 비타민 K는 제X인자(factor X)와 같은 혈액 응고에 관여하는 단백질 중 아미노산의 글루탐산을 수식해 세포 표면에 강하게 결합할 수 있도록 하는 효소에 의해 사용된다. PDB 엔트리 6wv5의 구조는 이 반응을 돕는 효소를 보여주는데, 이는 강력한 항응고제인 와파린(warfarin)의 표적이다. 비타민 K는 많은 역할을 하고 있다. 비타민 K는 식물에서는 매우 다르게 작용하며 ‘필로퀴논’(phylloquinone)이라는 이름으로 불린다. 이것은 광화학계I(photosystem I)과 같은 단백질 내에서 전자의 이동을 관리하는 데 도움이 되고 있다.
도구 준비
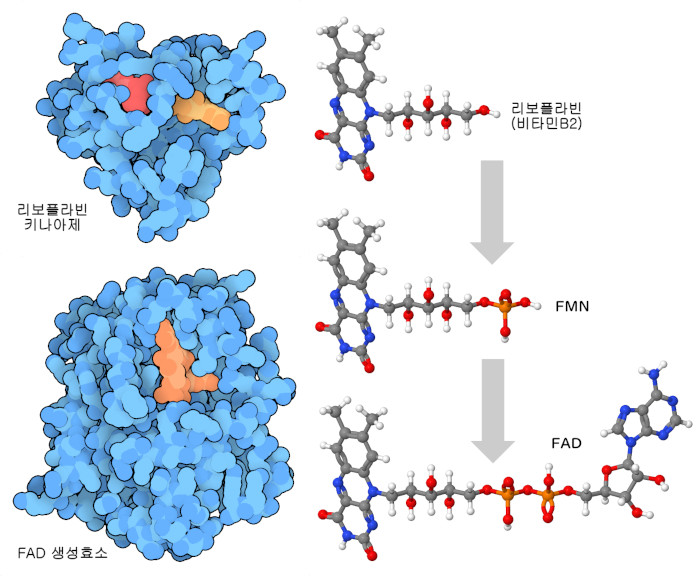
비타민 B군은 화학기나 전자 운반에 사용되기 때문에 이를 이용하는 효소에 의해 매우 주의 깊게 자리 잡을 필요가 있다. 그러나 비타민 B군 중 몇몇은 분자가 작아 관리가 어렵기 때문에 세포는 이들에게 편리한 화학적 핸들을 부가한다. 예를 들어 뉴클레오타이드가 리보플라빈(비타민 B2)(riboflavin(vitamin B2))에 부가되어 FAD가 만들어지고, 나이아신(비타민 B3)(niacin(vitamin B3))에도 비슷한 핸들이 부가되어 NAD가 생긴다. 2개의 효소가 리보플라빈을 사용할 준비를 한다. 우선 리보플라빈 키나아제(riboflavin kinase, PDB 엔트리 1p4m)가 인산을 부가하고, 다음으로 FAD 합성효소(FAD synthetase, PDB 엔트리 2wsi)가 뉴클레오타이드를 부가한다.
자기들끼리 하다
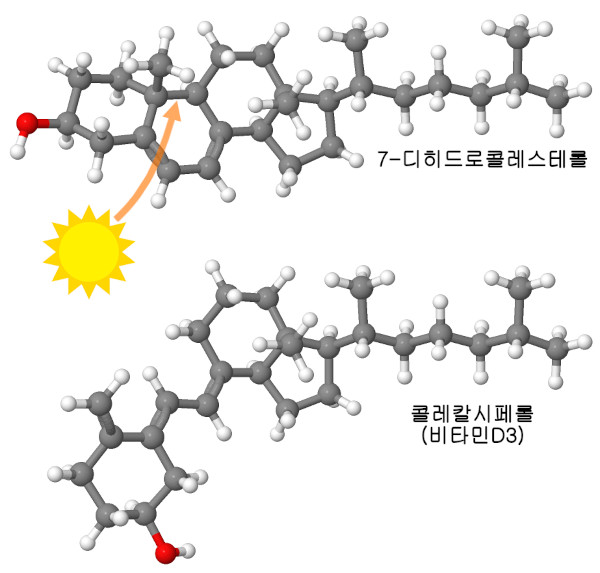
이 절에서는 2개의 비타민을 중심으로 이야기를 진행한다. 우리 세포는 이 비타민들을 만들 수 있지만 충분하지 않을 수도 있다. 나이아신(비타민 B3)은 모든 생합성 경로와 에너지 생산 경로에서 사용되는 중심적인 전자 운반책인 NADH를 만드는 데 사용된다. 예를 들어 해당계(glycolysis)나 구연산 회로(citric acid cycle)의 효소에서 거대한 NADH 디히드로게나아제 복합체(NADH dehydrogenase complex)로 전자를 운반한다. 우리의 세포는 아미노산의 트립토판에서 나이아신을 만들 수는 있지만 그 과정은 비효율적이기 때문에 우리는 주로 식사로부터의 섭취에 의존한다. 비타민 D는 피부에서 햇빛을 쬐면서 콜레스테롤의 일종이 화학적으로 재편성되어 생긴다. 햇볕이 강한 지역에 살고 있다면 전혀 문제가 없지만 그렇지 않은 경우에는 대구 간유나 기타 영양보조식품에서 섭취할 필요가 있을지도 모른다.
특별 배달
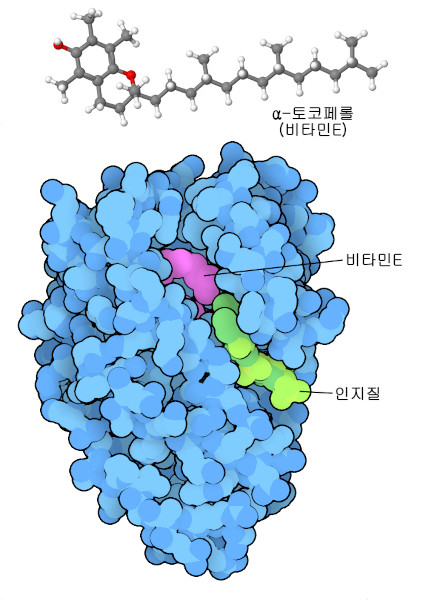
경우에 따라 우리 몸은 비타민을 필요한 곳에 전달하기 위해 특별한 노력을 할 필요가 있다. 예를 들어 비타민 E(토코페롤)(vitamin E(tocopherol))는 지용성의 항산화 물질로 우리의 세포막을 보호하고 있다. 이는 물에 잘 녹지 않기 때문에 우리는 토코페롤 운반 단백질을 만들어 혈류를 통해 필요한 곳으로 전달하고 있다. 이 단백질 구조(PDB 엔트리 3w67)를 보면 비타민은 단백질 내부에서 보호받고 있지만 표적 세포에 도달하면 가까운 홈에 있는 지질이 결합하여 단백질을 열고 비타민을 방출할 수 있다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
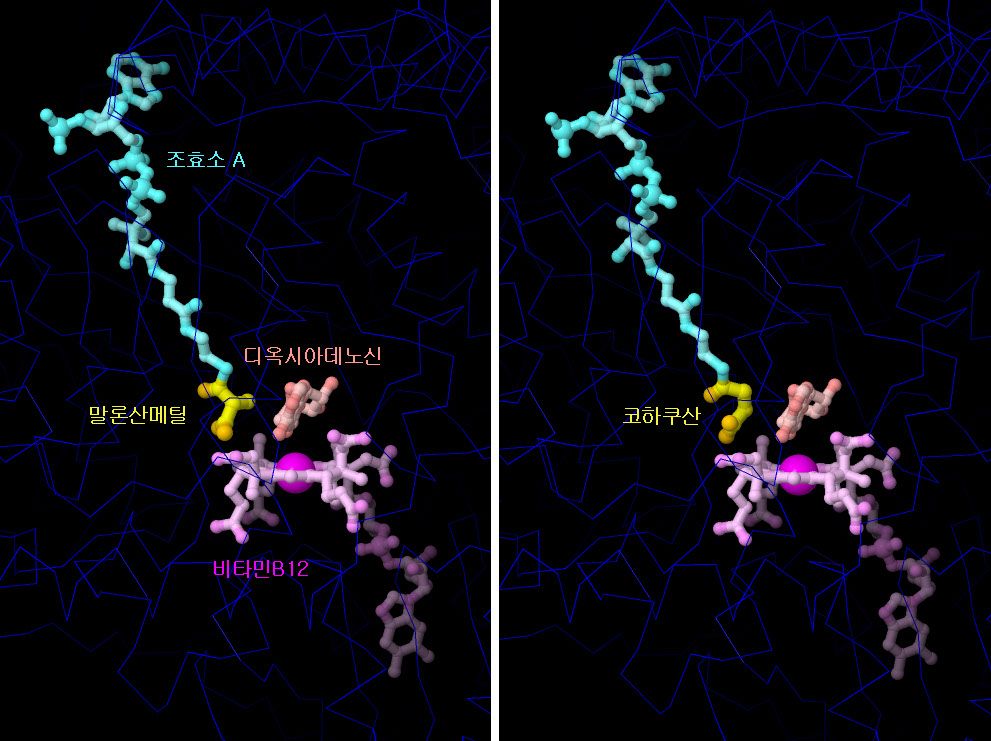
가장 큰 비타민인 비타민 B12(코발라민)(vitamin B12(cobalamin))를 이용하는 것은 우리 세포 중에서도 극히 일부 효소뿐이다. 여기에 나타낸 것은 메틸말로닐-CoA (methylmalonyl coenzyme A mutase, PDB 엔트리 4req)로, 탄소 원자를 제거하고 약간 다른 장소로 치환함으로써 말론산메틸(methylmalonate)과 코하쿠산(succinate)을 서로 변환한다. 반응 중에 비타민 B5를 사용해 만들어지는 분자가 보조 인자인 보효소 A에 의해 비타민 B12 근처에서 유지된다. 이것은 아미노산을 분해하고 구연산 회로구연산 회로의 연료가 되는 코하쿠산으로 변환하는 과정에서 중요한 단계이다. 이 구조에는 양쪽 상태의 분자가 포함되어 있다. 이 반응은 비타민 B12의 중심에 있는 코발트 원자가 근처에 있는 분자 디옥시아데노신(deoxyadenosine)의 도움을 받아 수행한다. 그림 아래에 있는 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환하고 이 구조를 보다 자세히 살펴 보기 바란다.
이해를 높이기 위한 토픽
- PDB 아카이브에 등록되어 있는 구조의 대부분에 비타민 분자가 포함되어 있습니다. 비타민의 PDBj 화합물 페이지에 접속하여 ‘관련된 PDB 엔트리’ 탭을 보면 그 분자를 포함한 PDB 엔트리를 찾을 수 있습니다. 예를 들어 이 비타민 B12 페이지를 확인하면 현재 100개 이상의 엔트리에 포함되어 있는 것을 알 수 있습니다.
- 비타민의 공급원과 건강 효과에 대한 자세한 정보는 미국국립의학도서관 페이지(영어)를 참조하십시오.
참고문헌
- 7zsc 2022 Crystal structure of the collagen prolyl 4-hydroxylase (C-P4H) catalytic domain complexed with PDI: Toward a model of the C-P4H alpha 2 beta 2 tetramer. J Biol Chem 298 102614-102614
- 6wv5 2021 Structural basis of antagonizing the vitamin K catalytic cycle for anticoagulation. Science 371 eabc5667
- 4bta 2013 The structural motifs for substrate binding and dimerization of the alpha subunit of collagen prolyl 4-hydroxylase. Structure 21 2107-2118
- 2013 Widespread decay of vitamin-related pathways: coincidence or consequence? Trends Genetics 29 469-478
- 3w67 2013 Impaired alpha-TTP-PIPs interaction underlies familial vitamin E deficiency. Science 340 1106-1110
- 3fpz 2011 Saccharomyces cerevisiae THI4p is a suicide thiamine thiazole synthase. Nature 478 542-546
- 2wsi 2010 Crystal structure of yeast FAD synthetase (Fad1) in Complex with Fad. J Mol Biol 398 641-646
- 2biw 2005 The structure of a retinal-forming carotenoid oxygenase. Science 308 267-269
- 1p4m 2003 Crystal structure of human riboflavin kinase reveals a beta barrel fold and a novel active site arch. Structure 11 265-273
- 4req 1998 Conformational changes on substrate binding to methylmalonyl CoA mutase and new insights into the free radical mechanism. Structure 6 711-720
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트