279: 後期促進複合体/サイクロソーム(Anaphase-Promoting Complex / Cyclosome)
この記事および記事中の図は、定量生物医学ラトガース研究所(Rutgers Institute for Quantitative Biomedicine)が主催する大学生・大学院生向けの1週間集中合宿の一環として、ザラ・ブカーリ(Zara Bukhari)、エドゥアルド・チャパロ=バリエラ(Eduardo Chaparro-Barriera)、ケーシー・H・グリーンバーグ(Casey H. Greenberg)、ヴァーナ・ヴァン(Verna Van)によって執筆・制作されたものです。またこの記事は、2023-2024年のPDB-101健康特集「がんに関する生物学と治療法」(health focus on "Cancer Biology and Therapeutics") の一部として発表されたものです。
細胞が成長し分裂するとき、新しい細胞が元の細胞の真のコピーであることを確認するために、いくつかのチェックポイントを通過する必要がある。チェックポイントを通過できなかった細胞は、多くの場合アポトーシス(プログラムされた細胞死)を起こし、分裂して有害な変異が受け継がれるのを防ぐ。細胞周期が円滑に進むように、さまざまな種類のタンパク質がチェックポイントを守っている。しかし、これらのタンパク質が正しく動作しなくなり、細胞がチェックを受けることなくチェックポイントを通過してしまうと、細胞は制御されることなく増殖し、がん化してしまう可能性がある。
破壊対象の印をつける
後期促進複合体/サイクロソーム(Anaphase-promoting complex / cyclosome、APC/C)は、細胞周期における中心的な門番である。APC/Cは、細胞周期を構成する多くの段階を監視する巨大なタンパク質複合体で、その名前は、細胞周期を構成する段階の一つ「後期」(anaphase)の進行を促すことを示している。APC/Cは、制御タンパク質を取り除き、細胞がある段階から次の段階へ移行するのを助ける。これらの制御タンパク質には、細胞周期の各段階の引き金となるサイクリン(cyclin)や、DNA複製や染色体分離といった細胞周期の重要な仕事を担うしくみを制御するタンパク質が含まれる。細胞周期の各段階が完了に近づくと、APC/Cは制御タンパク質に結合し、ユビキチン(ubiquitin)を付着させて、プロテアソーム(proteasome)による分解の標的となるようにする。
APC/Cが活動する様子
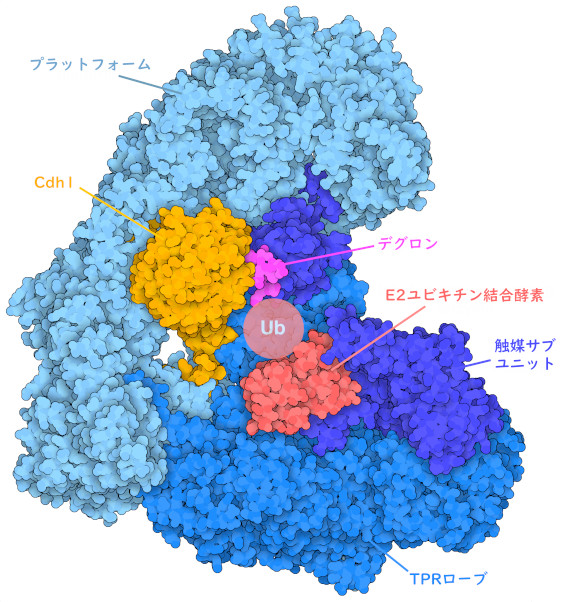
APC/CはE3ユビキチンリガーゼ(E3 ubiquitin ligase)の一つであり、他のE3酵素と同様に、複数のタンパク質をまとめる足場として機能する。APC/Cは、「TPRローブ」(TPR lobe、いくつかのタンパク質で見られる特徴的な「テトラトリコペプチドリピート」(tetratricopeptide repeat)の折りたたみパターンから命名)、プラットフォーム領域、触媒サブユニットという3つの機能領域を持っている。TPRローブは、Cdh1とCdc20という2種類のアダプタータンパク質を細胞周期の異なる時期に配置し、分解予定の標的タンパク質を特異的に認識させる。標的タンパク質は、アダプタータンパク質によって認識される特徴的な「デグロン」(degron)配列を含んでいる。PDBエントリー5a31に登録されているAPC/Cの構造は、アダプタータンパク質Cdh1と標的タンパク質のデグロン配列に相当するペプチドを表している。APC/Cのプラットフォーム領域は、触媒モジュールをデグロン配列に対して最適な位置に配置し、Cdc20のTPRローブへの結合を制御している。最後に、APC/Cの触媒モジュールは、ユビキチンを供給するE2ユビキチン結合酵素(E2 ubiquitin-conjugating enzyme)と結合し、E2から標的タンパク質へのユビキチンの移行を触媒する。ユビキチン化反応は何度も繰り返され、複数のユビキチンが連結した鎖を標的タンパク質に結合させることができる。
がんとのつながり
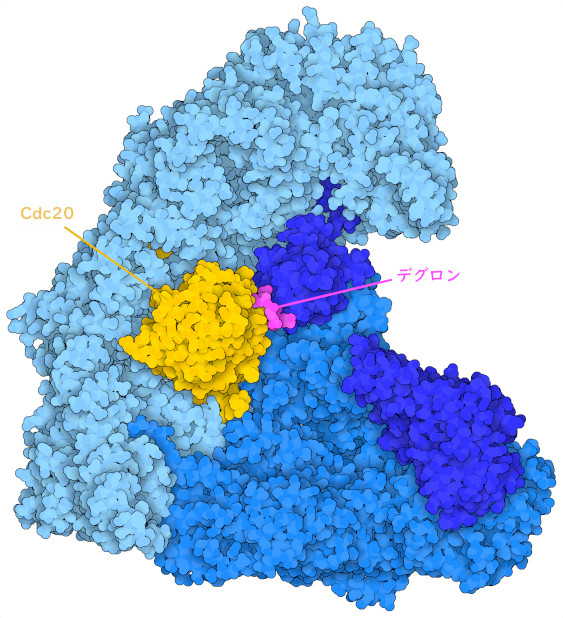
もう一つのAPC/Cアダプタータンパク質であるCdc20(ここに示すのはPDBエントリー5g04の構造)は、細胞周期後期を監視するのに役立っている。Cdc20は細胞分裂の初期にAPC/Cと結合し、複製された染色体をつなぎ止めているタンパク質を分解する反応経路を始動させて、染色体が2つの娘細胞へと分離できるようにする。しかし、Cdc20を過剰発現させると、染色体が正しく揃っていなくてもこの段階が進むようになり、場合によっては染色体が損傷した細胞が作られてしまう。このようなゲノムの不安定性は、がん細胞でしばしば見られる異常な増殖特性を生み出すのに役立つと考えられている。Cdc20の過剰発現は、長い間、さまざまな種類のがんと関連してきた。APC/Cとそのアダプターは、がんの生物学における中心的な役割を担っているため、抗がん剤の開発において有望な標的となる。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
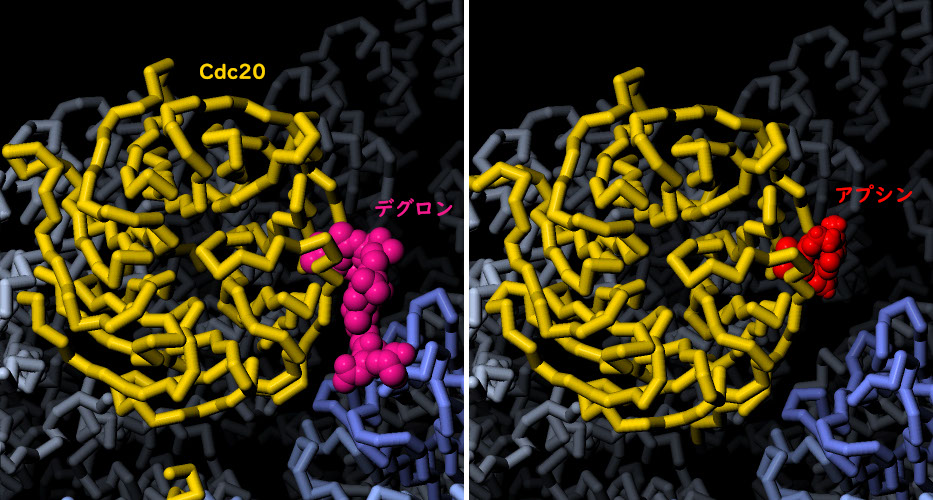
「APC 阻害剤」にちなんで命名された低分子阻害剤のアプシン(Apcin)は、現在、がんの治療法になり得るものとして評価されている。デグロンを認識する部位でCdc20に結合することにより、APC/Cによる標的タンパク質の認識を阻害する。ここに示すのは、Cdc20 に結合したアプシンでPDBエントリー4n14由来の構造である。また、PDBエントリー5g04で登録されているデグロン複合体の構造と比較して示している。図の下のボタンをクリックして対話的操作のできる画像に切り替え、この小さな薬がどのようにして大きなAPC/Cの機能を阻害しているのかを確認してみて欲しい。
理解を深めるためのトピックス
- APC/Cは、細胞周期の過程で多くの調節タンパク質に結合します。例えば、PDBエントリー5lcwでは有糸分裂チェックポイント複合体とAPC/Cの複合体を調べることができます。
-
構造を調べるとき、Cdc20には特徴的な7枚刃の
β プロペラの折りたたみ構造(フォールド)があることに注目してください。PDBjサイトでの検索やRCSB PDBサイトにある「CATH」分類の「Browse by Annotation」機能を使って、この折りたたみ構造を持つ他のタンパク質を調べることができます。
参考文献
- 2022 Design, synthesis, and biological evaluation of Apcin-based CDC20 inhibitors. ACS Med Chem Lett 13 188–195
- 2022 CDC20 in and out of mitosis: a prognostic factor and therapeutic target in hematological malignancies. J Exp Clin Cancer Res 41 159
- 2020 APC/C ubiquitin ligase: Functions and mechanisms in tumorigenesis. Seminars in Cancer Biology 67 80–91
- 5g04 2016 Molecular Mechanism of Apc/C Activation by Mitotic Phosphorylation. Nature 533 260-264
- 5a31 2015 Atomic Structure of the Apc/C and its Mechanism of Protein Ubiquitination. Nature 522 450-454
- 4n14 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646-649
- 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646–649
- 2008 Regulation of APC/C Activators in Mitosis and Meiosis. Annu Rev Cell Dev Biol 24 475–499
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









