279: 后期促进复合物/细胞周期体(Anaphase-Promoting Complex / Cyclosome)
这篇文章和文章中的插图是由Zara Bukhari,Eduardo Chaparro-Barriera,Casey H. Greenberg和Verna Van撰写和制作的,作为罗格斯定量生物医学研究所(Rutgers Institute for Quantitative Biomedicine)组织的为期一周的本科生和研究生强化训练营的一部分。这也作为2023-2024年PDB-101健康重点 "癌症生物学和治疗学 "(health focus on "Cancer Biology and Therapeutics")的一部分发表。
当细胞生长和分裂时,它们需要通过几个检测点,以确保新细胞是原始细胞的真正拷贝。未能通过检测的细胞往往会发生凋亡(程序性细胞死亡),以防止它们分裂和传递有害突变。许多不同类型的蛋白质会保护这些检测点,以确保细胞周期的顺利进行。然而,如果这些蛋白质不能正确运作,细胞在没有被检测的情况下通过检测点,它们就会不受控制地增殖,变成癌症。
标记要销毁的目标
后期促进复合物/细胞周期体(Anaphase-promoting complex / cyclosome,APC/C)是细胞周期的核心守门员。APC/C是一个大型蛋白质复合物,它监测细胞周期的许多阶段,其名称表明它促进了构成细胞周期的一个阶段--"晚期"(anaphase)的进展。APC/C可去除调节蛋白,帮助细胞从一个阶段进入下一个阶段。这些调节蛋白包括触发细胞周期各个阶段的细胞周期蛋白(cyclin),以及控制 DNA 复制和染色体分离等关键细胞周期任务机制的蛋白质。当细胞周期的每个阶段接近完成时,APC/C与调节蛋白结合并附着泛素(ubiquitin),使其成为蛋白酶体(proteasome)降解的目标。
APC/C在行动
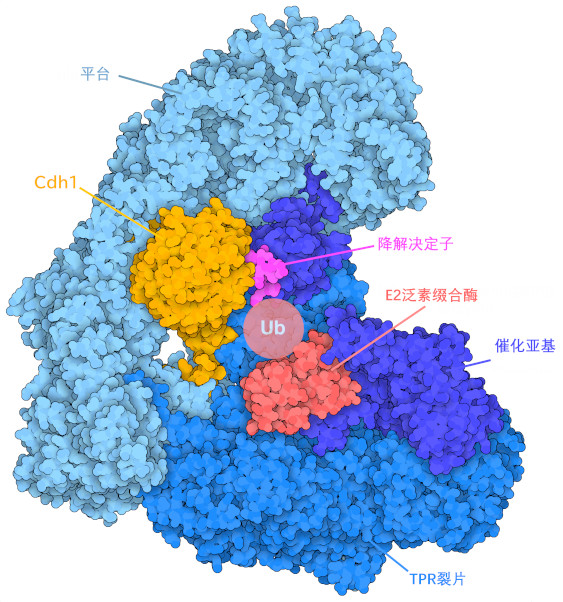
后期促进复合体/细胞周期体APC/C是一种E3泛素连接酶(E3 ubiquitin ligase),与其他E3酶一样,它作为一个支架,将多种蛋白质聚集在一起。APC/C有三个功能区:"TPR叶"(以某些蛋白质中特有的 "四肽重复"折叠模式命名)、平台区和催化亚基单位。TPR叶在细胞周期的不同时期定位两个不同的适配蛋白,Cdh1和Cdc20,以专门识别注定要降解的目标蛋白。目标蛋白包含一个由适配蛋白识别的特征 "降解决定子"(degron)序列;PDB条目5a31中APC/C的结构显示了适配蛋白Cdh1和代表目标蛋白的降解决定子序列所对应的肽。APC/C中的平台区域使催化模块相对于降解决定子序列处于最佳位置,并控制Cdc20与TPR叶的结合。最后,APC/C中的催化模块与提供泛素的E2泛素结合酶(E2 ubiquitin-conjugating enzyme)结合,并催化泛素从E2转移到目标蛋白。泛素化反应重复多次,允许多个泛素连接链与目标蛋白结合。
与癌症的关联
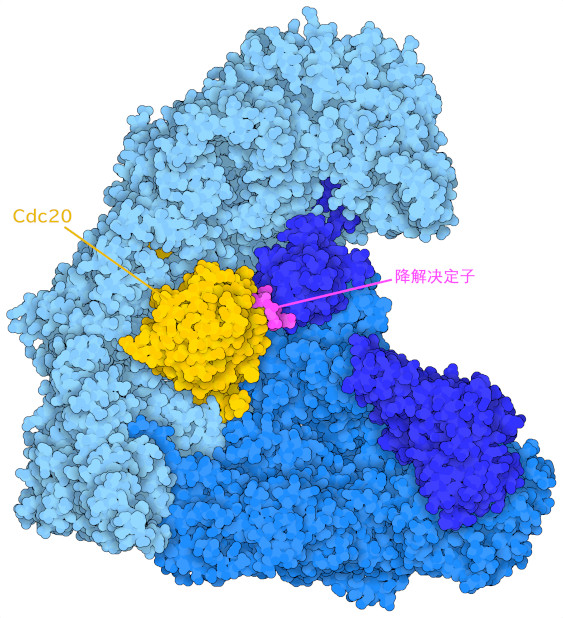
另一个APC/C适应蛋白Cdc20(这里显示的是PDB条目5g04的结构),有助于监测细胞周期后期:它在细胞分裂早期与APC/C结合,并启动一个反应途径,降解固定复制的染色体的蛋白质这使得染色体能够分离成两个子细胞。然而,即使染色体没有正确排列,Cdc20的过量表达也可以使这一步骤得以进行,在某些情况下会导致产生染色体受损的细胞。这种基因组的不稳定性被认为有助于产生在癌细胞中经常看到的异常生长特征。长期以来,Cdc20的过度表达与许多不同种类的癌症有关。由于其在癌症生物学中的核心作用,APC/C及其适配体是开发抗癌药物的受关注目标。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试直接点击图表。
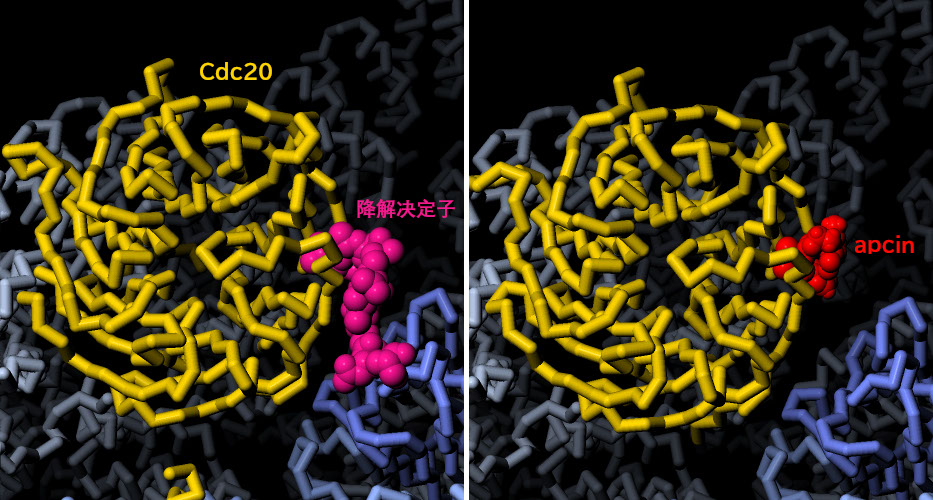
以 "APC抑制剂 "命名的小分子抑制剂apcin,现在被评估为一种潜在的癌症治疗药物。它通过结合在Cdc20中识别降解决定子的结合部位,来抑制APC/C对目标蛋白的识别。这里显示的是来自PDB4n14的结构,该蛋白酶与Cdc20结合。图中还显示了与PDB5g04中降解决定子复合体的结构对比。点击图下方的按钮,切换到可操作的交互式图像,看看这个小分子药物是如何抑制较大的APC/C的功能的。
进一步的讨论议题
- APC/C在细胞周期中与许多调节蛋白结合。例如,你可以在PDB 5lcw中探索APC/C与含有有丝分裂检检测点组成的复合物。
- 在探索该结构时,请注意Cdc20具有一个独特的七叶β螺旋折叠结构;使用PDBj搜索或者RCSB PDB网站上的"CATH"分类中的"按注释浏览"功能,可以找到具有这种折叠结构的蛋白质。
参考文献
- 2022 Design, synthesis, and biological evaluation of Apcin-based CDC20 inhibitors. ACS Med Chem Lett 13 188–195
- 2022 CDC20 in and out of mitosis: a prognostic factor and therapeutic target in hematological malignancies. J Exp Clin Cancer Res 41 159
- 2020 APC/C ubiquitin ligase: Functions and mechanisms in tumorigenesis. Seminars in Cancer Biology 67 80–91
- 5g04 2016 Molecular Mechanism of Apc/C Activation by Mitotic Phosphorylation. Nature 533 260-264
- 5a31 2015 Atomic Structure of the Apc/C and its Mechanism of Protein Ubiquitination. Nature 522 450-454
- 4n14 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646-649
- 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646–649
- 2008 Regulation of APC/C Activators in Mitosis and Meiosis. Annu Rev Cell Dev Biol 24 475–499
 生物大分子学习的教育门户
生物大分子学习的教育门户 









