236: サイクリンとサイクリン依存性キナーゼ(Cyclin and Cyclin-dependent Kinase)
細胞分裂は厳重に制御されているが、それにはそうすべき十分な理由がある。胚(胎児)の発生初期には多くの細胞が分裂して増殖する。しかしその後の生涯では、ほとんどの細胞が特定の役割に特化し細胞分裂する必要はなくなる。分裂し続ける必要があるのは、皮膚細胞や免疫系細胞など何種類かの細胞だけである。細胞がいつ分裂しいつ分裂すべきでないのかを制御しているのはサイクリン(cyclin)とサイクリン依存性キナーゼ(cyclin-dependent kinase、CDK)である。制御なき増殖はがんの特徴の一つなので、制御は絶対に欠かすことはできない。
細胞周期とチェックポイント
細胞の成長と分裂は一連の過程を繰り返して行われており、その過程はいくつかの段階に分けられる。G1期(G1 phase)では、必要となるすべてのタンパク質、リボソーム、およびその他の機械が合成される。そして十分な量が用意できるとS期(S phase)に移行し、ここでDNAが複製される。G2期(G2 phase)と呼ばれるギャップ期(成長期)を過ぎると、細胞分裂を行うM期(M phase)に移行し細胞は分裂する。そして二つの細胞は細胞分裂の全手順を再び始めていくことができるようになる。細胞周期は、 各期からその次の期へ進むかどうかを監視しているサイクリンとサイクリン依存性キナーゼによって制御されている。
機械を動かす
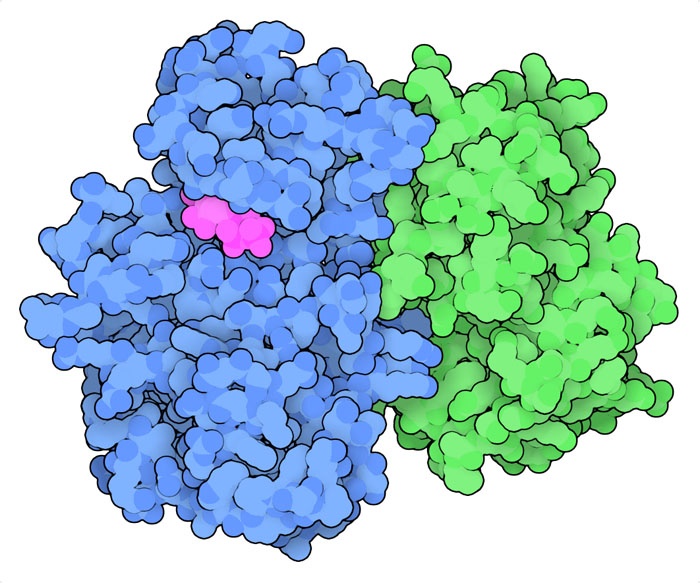
サイクリンとCDKは一緒になってチェックポイントを監視している。サイクリンの濃度は、ユビキチン(ubiquitin)とプロテアソーム(proteasome)のはたらきによって通常は低く保たれている。条件が整うと、サイクリンの濃度が上昇できるようになり、相手となるCDKと結合する。その構造をここに示す(PDBエントリー1fin)。続いてキナーゼは自分自身をリン酸化して活性を高める。そしてDNA合成、細胞分裂など細胞周期のある特定の段階で必要とされるはたらきに関わる多くのタンパク質をリン酸化する。
細胞周期を調整する
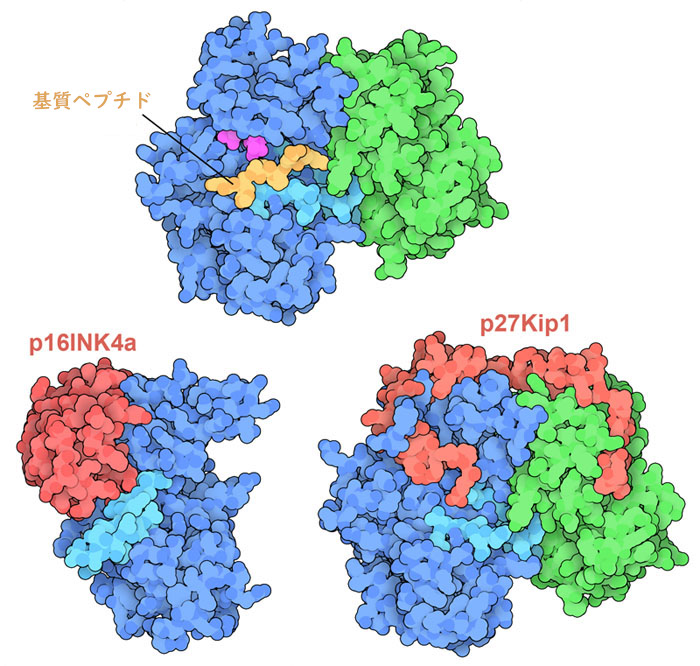
その他にも多くのタンパク質が細胞周期の制御を助けている。例えばここに示す2つは、DNA複製の前段階でDNAの損傷を修復する必要があるときにCDK6と結合し作用を遅らせる。INK4阻害剤(ここに示すのはPDBエントリー1bi7)はCDKに結合して重要な活性部位ループ(水色)を移動させる。それによりタンパク質は不活性化され、サイクリンとの相互作用に大きな影響が出る。Kip1阻害剤(ここに示すのはPDBエントリー1jsu)は活性部位へと巧みに入り込み、ATPの結合を阻害する。これらの阻害剤が結合した構造(下二つ)と、サイクリンとCDKに対象タンパク質由来の小さなペプチドが結合した構造(上、PDBエントリー1qmz)と比較してみて欲しい。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
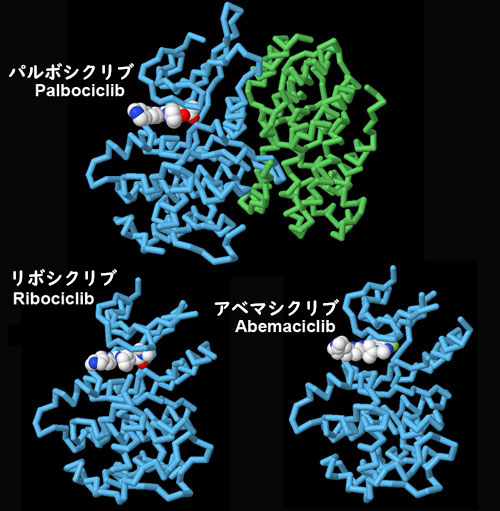
CDK酵素はがん治療における作用対象となる。なぜならこれを阻害すると腫瘍細胞の異常な成長を止めることができるからである。多くの研究は、細胞がDNA複製を始める前の重要な制限ポイントを監視しているCDK4とCDK6に注目して行われている。FDA(Food and Drug Adminstration、アメリカ食品医薬品局)が承認した3つの薬剤に関する構造(PDBエントリー2euf、5l2t、5l2s)をここに示す。いずれも構造に基づいて設計され見出されたものである。いずれも異なる化学構造を持つが、酵素の活性部位に似たような方法で結合し、ATPと結合して対象タンパク質をリン酸化する機能を妨げる。図の下のボタンをクリックして対話的操作のできる画像に切り替え、これらの構造をより詳しく比較してみて欲しい。
理解を深めるためのトピックス
- 別の阻害剤とCDKが結合した構造もたくさん決定されています。CDK阻害剤(「CDK inhibitor」または「cyclin dependent kinase inhibitor」)で検索し、それらを見てみてください。
- キナーゼは二つのドメインで構成され、その両ドメインの間に活性部位が作られることがよくあります。CDKの構造を他のキナーゼ、例えばMAPキナーゼ(MAP kinase、よく似ていて共通の祖先となる酵素から進化したと考えられている酵素)や解糖系ホスホグリセリン酸(glycolytic phosphoglycerate kinase、かなり異なる酵素)と比較してみてください。
参考文献
- 2019 Cyclin-dependent protein serine/threonine kinase inhibitors as anticancer drugs. Pharmacol. Res. 139 471-488
- 5l2s、5l2t 2016 Spectrum and Degree of CDK Drug Interactions Predicts Clinical Performance. Mol.Cancer Ther. 15 2273-2281
- 2euf 2006 Toward understanding the structural basis of cyclin-dependent kinase 6 specific inhibition. J.Med.Chem. 49 3826-3831
- 1qmz 1999 The Structural Basis for Specificity of Substrate and Recruitment Peptides for Cyclin-Dependent Kinases. Nat.Cell Biol. 1 438-443
- 1bi7 1998 Structural basis for inhibition of the cyclin-dependent kinase Cdk6 by the tumour suppressor p16INK4a. Nature 395 237-243
- 1jsu 1996 Crystal structure of the p27Kip1 cyclin-dependent-kinase inhibitor bound to the cyclin A-Cdk2 complex. Nature 382 325-331
- 1fin 1995 Mechanism of CDK activation revealed by the structure of a cyclinA-CDK2 complex. Nature 376 313-320
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









