279후기 촉진 복합체/사이클로솜 (Anaphase-Promoting Complex / Cyclosome)
이 기사 및 기사 내의 그림은 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine)가 주최하는 대학생 및 대학원생을 위한 1주일간 집중 합숙의 일환으로 자라 부하리(Zara Bukhari), 에두아르도 차파로-바리에라(Eduardo Chaparro-Barriera), 케이시 H. 그린버그(Casey H. Greenberg), 버나 반(Verna Van)에 의해 집필 및 제작된 것입니다. 또한 이 기사는 2023~2024년 PDB-101 건강특집 ‘암에 관한 생물학과 치료법’(health focus on “Cancer Biology and Therapeutics”)의 일부로 발표된 것입니다.
세포가 성장하고 분열할 때 새로운 세포가 원래 세포의 진정한 복제물인지 확인하기 위해 몇 가지 체크 포인트를 통과해야 한다. 체크 포인트를 통과하지 못한 세포는 많은 경우 아포토시스(프로그램된 세포사)를 일으키고 분열되어 유해한 변이가 대물림되는 것을 막는다. 세포 주기가 원활하게 진행될 수 있도록 다양한 종류의 단백질이 체크 포인트를 지키고 있다. 하지만 이들 단백질이 제대로 작동하지 않아 세포가 체크를 받지 않고 체크 포인트를 통과해버리면 세포는 제어되지 않고 증식해 암화해버릴 가능성이 있다.
파괴 대상의 표시를 하다
후기 촉진 복합체/사이클로솜(Anaphase-promoting complex / cyclosome, APC/C)은 세포 주기의 중심적인 문지기이다. APC/C는 세포 주기를 구성하는 많은 단계를 감시하는 거대한 단백질 복합체로, 그 이름은 세포 주기를 구성하는 단계 중 하나인 ‘후기(後期)’(anaphase)의 진행을 촉진한다는 것을 나타낸다. APC/C는 제어 단백질을 제거하고 세포가 어떤 단계에서 다음 단계로 이행하는 것을 돕는다. 이들 제어 단백질에는 세포 주기의 각 단계를 촉발하는 사이클린(cyclin)이나, DNA 복제나 염색체 분리와 같은 세포 주기의 중요한 일을 담당하는 구조를 제어하는 단백질이 포함된다. 세포 주기의 각 단계가 완료에 가까워지면 APC/C는 제어 단백질에 결합하고 유비퀴틴 (ubiquitin)을 부착시켜 프로테아솜 (proteasome)에 의한 분해의 표적이 되도록 한다.
APC/C가 활동하는 모습
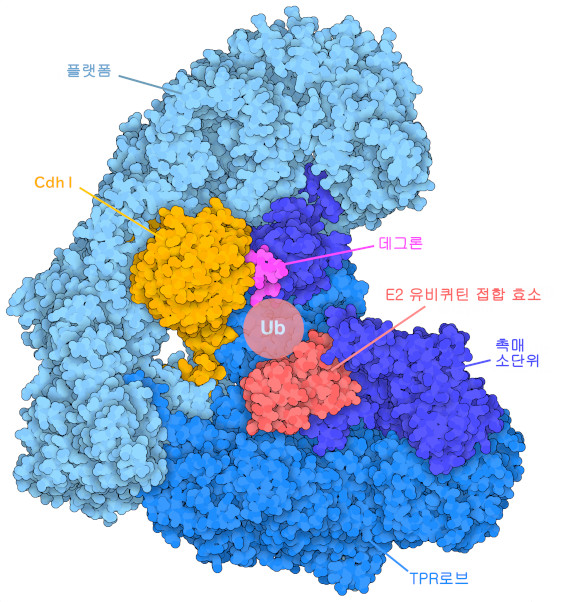
APC/C는 E3 유비퀴틴 리가아제(E3 ubiquitin ligase)의 하나로, 다른 E3 효소와 마찬가지로 여러 단백질을 하나로 모으는 발판으로 기능한다. APC/C는 ‘TPR 로브’(TPR lobe, 몇몇 단백질에서 볼 수 있는 특징적인 ‘테트라트리코펩타이드 리피트’(tetratricopeptide repeat)의 접이식 패턴에서 명명), 플랫폼 영역, 촉매 서브유닛이라고 하는 3개의 기능 영역을 가지고 있다. TPR 로브는 Cdh1과 Cdc20이라는 2종류의 어댑터 단백질을 세포 주기가 다른 시기에 배치해 분해 예정인 표적 단백질을 특이적으로 인식시킨다. 표적 단백질은 어댑터 단백질에 의해 인식되는 특징적인 ‘데그론’(degron) 배열을 포함하고 있다. PDB 엔트리 5a31에 등록된 APC/C의 구조는 어댑터 단백질 Cdh1과 표적 단백질의 데글론 배열에 상당하는 펩타이드를 나타낸다. APC/C의 플랫폼 영역은 촉매 모듈을 데그론 배열에 대해 최적의 위치에 배치하여 Cdc20의 TPR 로브로의 결합을 제어한다. 마지막으로 APC/C의 촉매 모듈은 유비퀴틴을 공급하는 E2 유비퀴틴 결합 효소(E2 ubiquitin-conjugating enzyme)와 결합하여 E2에서 표적 단백질로의 유비퀴틴 이행을 촉매한다. 유비퀴틴화 반응은 여러 차례 반복되어 여러 유비퀴틴이 연결한 사슬을 표적 단백질에 결합시킬 수 있다.
암과의 연결고리
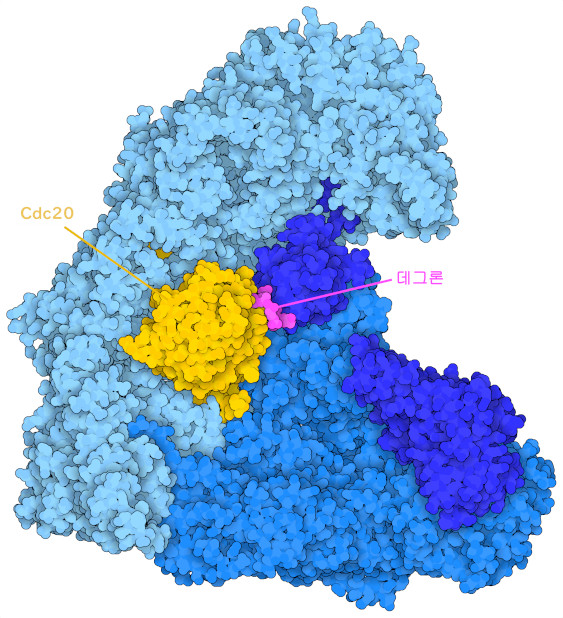
또 하나의 APC/C 어댑터 단백질인 Cdc20(여기에 나타낸 것은 PDB 엔트리 5g04의 구조)은 세포 주기 후기를 감시하는 데 도움이 되고 있다. Cdc20은 세포분열 초기에 APC/C와 결합하여 복제된 염색체를 이어 붙이는 단백질을 분해하는 반응 경로를 시작하여 염색체가 2개의 딸세포로 분리될 수 있도록 한다. 하지만 Cdc20을 과잉 발현시키면 염색체가 제대로 갖추어지지 않더라도 이 단계가 진행되게 되어 경우에 따라서는 염색체가 손상된 세포가 만들어져버린다. 이러한 게놈 불안정성은 암세포에서 흔히 볼 수 있는 비정상적인 증식 특성을 만들어내는 데 도움이 될 것으로 생각된다. Cdc20의 과잉 발현은 오랫동안 다양한 종류의 암과 관련되어 왔다. APC/C와 그 어댑터는 암 생물학의 중심적인 역할을 담당하고 있기 때문에 항암제 개발에 있어서 유망한 표적이 된다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
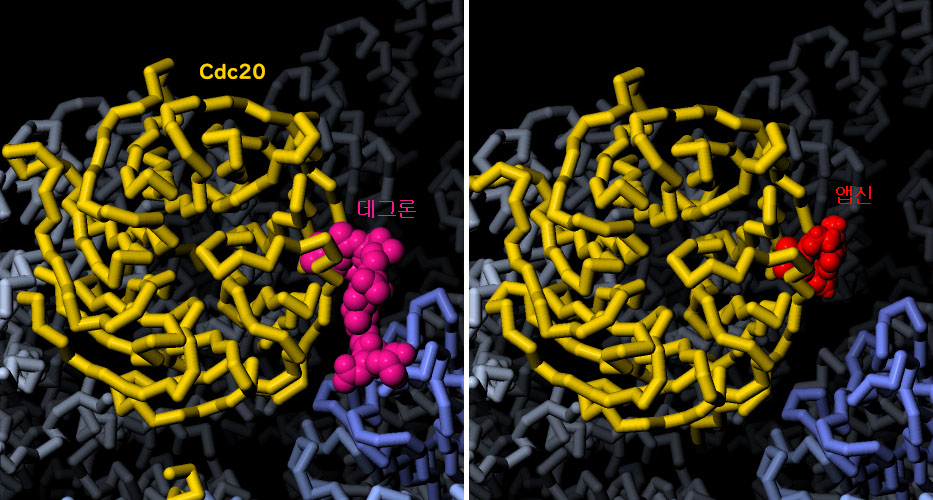
‘APC 저해제’를 따서 명명된 저분자 저해제 앱신(Apcin)은 현재 암 치료법이 될 수 있는 것으로 평가받고 있다. 데그론을 인식하는 부위에서 Cdc20에 결합함으로써 APC/C에 의한 표적 단백질 인식을 저해한다. 여기에 나타낸 것은 Cdc20에 결합한 앱신으로 PDB 엔트리 4n14에서 유래한 구조이다. 또한 PDB 엔트리 5g04로 등록되어 있는 데그론 복합체의 구조와 비교하여 나타내고 있다. 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 이미지로 전환하여 이 작은 약이 어떻게 큰 APC/C의 기능을 저해하는지 확인해 보기 바란다.
이해를 높이기 위한 토픽
- APC/C는 세포 주기 과정에서 많은 조절 단백질에 결합합니다. 예를 들어 PDB 엔트리 5lcw에서는 유사분열 체크 포인트 복합체와 APC/C 복합체를 살펴볼 수 있습니다.
- 구조를 조사할 때 Cdc20에는 특징적인 7중날 β 프로펠러 접이식 구조(폴드)가 있다는 점에 주목하십시오. PDBj 사이트에서의 검색이나 RCSB PDB 사이트에 있는 ‘CATH’ 분류의 ‘Browse by Annotation’ 기능을 사용하여 이 접이식 구조를 가진 다른 단백질을 살펴볼 수 있습니다.
참고문헌
- 2022 Design, synthesis, and biological evaluation of Apcin-based CDC20 inhibitors. ACS Med Chem Lett 13 188–195
- 2022 CDC20 in and out of mitosis: a prognostic factor and therapeutic target in hematological malignancies. J Exp Clin Cancer Res 41 159
- 2020 APC/C ubiquitin ligase: Functions and mechanisms in tumorigenesis. Seminars in Cancer Biology 67 80–91
- 5g04 2016 Molecular Mechanism of Apc/C Activation by Mitotic Phosphorylation. Nature 533 260-264
- 5a31 2015 Atomic Structure of the Apc/C and its Mechanism of Protein Ubiquitination. Nature 522 450-454
- 4n14 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646-649
- 2014 Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C. Nature 514 646–649
- 2008 Regulation of APC/C Activators in Mitosis and Meiosis. Annu Rev Cell Dev Biol 24 475–499











