267: 血管内皮増殖因子と血管新生(Vascular Endothelial Growth Factor (VegF) and Angiogenesis)
この記事は、定量生物医学ラトガース研究所(Rutgers Institute for Quantitative Biomedicine)の主催で開催された1週間の大学生・大学院生向け集中合宿の一環として、イーサン・カルタヘナ(Ethan Cartagena)、マリアン・ジェラシヴィリ(Mariam Gelashvili)、ジャスミン・キース(Jasmine Keyes)、エリザベス・ローゼンズワイグ(Elizabeth Rosenzweig)により執筆され、描かれたもので、2022-2023年 PDB-101の健康フォーカス「がん生物学と治療法」(Cancer Biology and Therapeutics)の一部としても掲載されています。
新しい血管をつくる
私たちの体は、絶えず新しい血管を作り、すべての細胞に必要な栄養を行き渡らせている。がん細胞(cancer cell)は、この血管新生(angiogenesis)と呼ばれるプロセスを利用して、増殖・転移する。血管新生は、信号伝達タンパク質である血管内皮増殖因子(vascular endothelial growth factor、VegF)によって刺激される。VegFが血流中に放出されると、複雑な分子ダンスが始まり、細胞間に開口部ができる。前駆内皮細胞(precursor endothelial cell)はこの開口部に移動し、新しい血管の内壁をつくることができる。がん細胞、特に転移能力が最も高く最も攻撃的なタイプのがん細胞は、血管新生の過程を操作している。腫瘍に至る新しい血管の成長を誘導することにより、がんは他の臓器に送られる栄養をそらし、がん周辺の組織に栄養を導く経路を作って、急速に成長し、転移することができる。
ペアをつくりあげて活性化
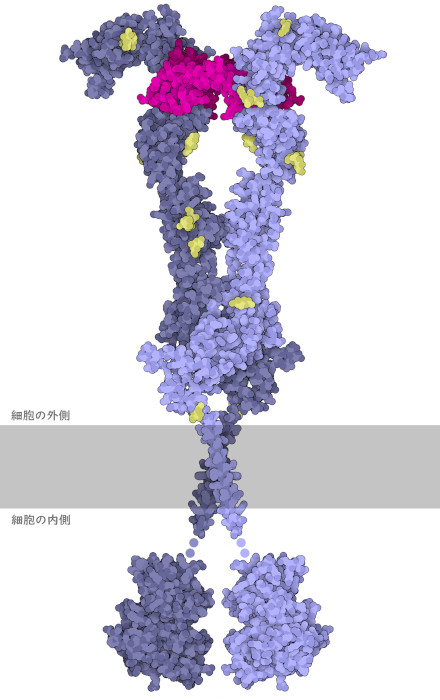
VegFは血管新生を開始するための信号を運び、VegFの細胞受容体でVegF受容体チロシンキナーゼ(VegF Receptor tyrosine kinase、VegFR)と呼ばれている膜貫通タンパク質によって受け取られる。非活性状態にあるとき、受容体は単一ユニットとして存在し、水の中を浮かぶ氷山のように細胞膜に沿って動いている。ところがVegFが結合すると、もう一つの受容体分子とペアになって活性のある2量体となる。ここに示しているのはこの活性型2量体である。受容体は非常に柔軟でかつ構造的に複雑であるため、この図を作成するには、細胞外にある外部ドメイン(extracellular ectodomain、PDBエントリー 5t89)、膜貫通ドメイン(transmembrane domain、PDBエントリー 2m59)、細胞内にあるチロシンキナーゼドメイン(intracellular tyrosine kinase domain、PDBエントリー 3hng)という3つのPDB構造データが必要であった。2量体化することにより、細胞膜の内側にある2つのチロシンキナーゼドメインが集まり、互いを活性化する。そして活性化されたチロシンキナーゼは、細胞内にある別の信号伝達タンパク質を刺激し、後述する接着結合(adherens junction)の解離など、血管新生に必要となるさまざまな過程を開始する。
ベバシズマブ:諸刃の剣
VegFによる信号発信はがんの増殖にとって重要な段階であるため、がん治療にとって有力な標的となる。ベバシズマブ(Bevacizumab、商品名 アバスチン Avastin)は、VegFに結合して受容体との結合を妨げるモノクローナル抗体(monoclonal antibody)である。VegFがベバシズマブと結合して不活性化されると、VegFRが2量体化する速度は遅くなり、血管新生の過程を遅らせることができる。これにより、酸素や栄養が腫瘍に早く到達するのを防ぐとともに、がん細胞が元の腫瘍から離脱して体の別の場所に移動する機会を減らすことができる。しかし、ベバシズマブによる治療は、がん細胞の増殖を抑制する効果がある一方で、傷の治癒(創傷治癒)を遅らせるなど他の過程において深刻な副作用を引き起こす可能性もある。
パイプラインを並べる
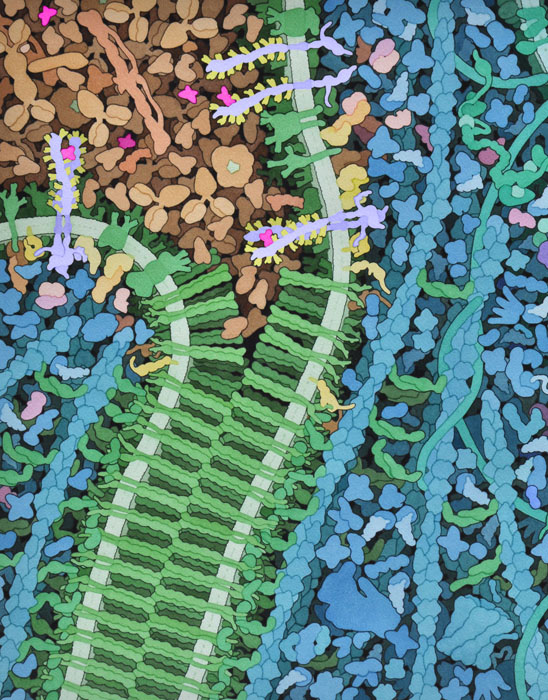
VegFによる信号は、急速に成長している腫瘍がつくり出すような栄養不足の条件下で始まり、酸素が不足することでVegF信号伝達タンパク質の生成と放出が促される。VegFタンパク質は血漿中を移動し、VegFRの外側ドメインに結合してこれを活性化する。信号は膜を越えて「伝達」され、VegFRのキナーゼドメインが、細胞内にあるさまざまな他の信号伝達タンパク質を活性化する。これらのうちいくつかは核に移動し、血管新生に関与する遺伝子の発現を変化させる。また、この信号伝達タンパク質は、細胞の境界面にあるカドヘリン(cadherin)タンパク質の細胞内部分をリン酸化する。これにより、まるでマジックテープを引きちぎって2つに分けるかのように、カドヘリンの膜外側部分を開くよう誘導される。血管の前駆細胞はこの開口部に引き寄せられ、新しい血管の内膜を形成する。
傷の治癒
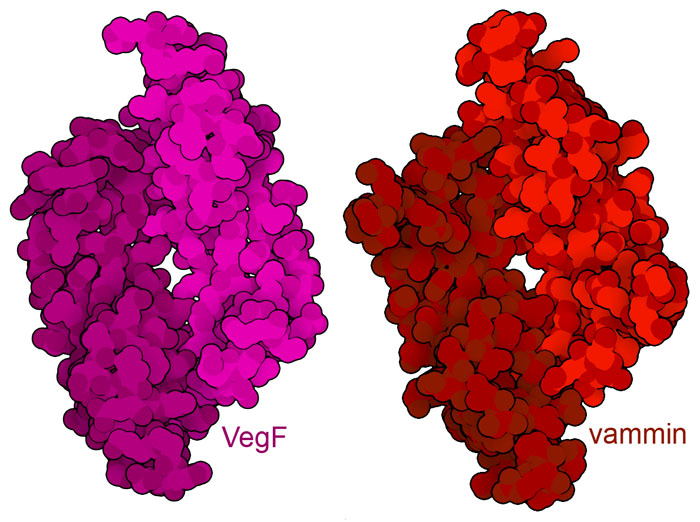
血管新生は、転移性腫瘍の進行を抑えるための重要な標的である。しかし、傷を治すなどの有益な過程を促すために、血管新生を促そうと考える場合もある。現在、VegFの構造をまねてその機能を複製したタンパク質が使えないかを探る研究が進められている。例えば、蛇の毒に由来するタンパク質の一つバミン(vammin、PDBエントリー1wq8)は、VegF(PDBエントリー1vpf)と比べ立体構造と配列の両面において非常によく似ており、VegFと同様にVegF受容体の活性化を誘発する。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
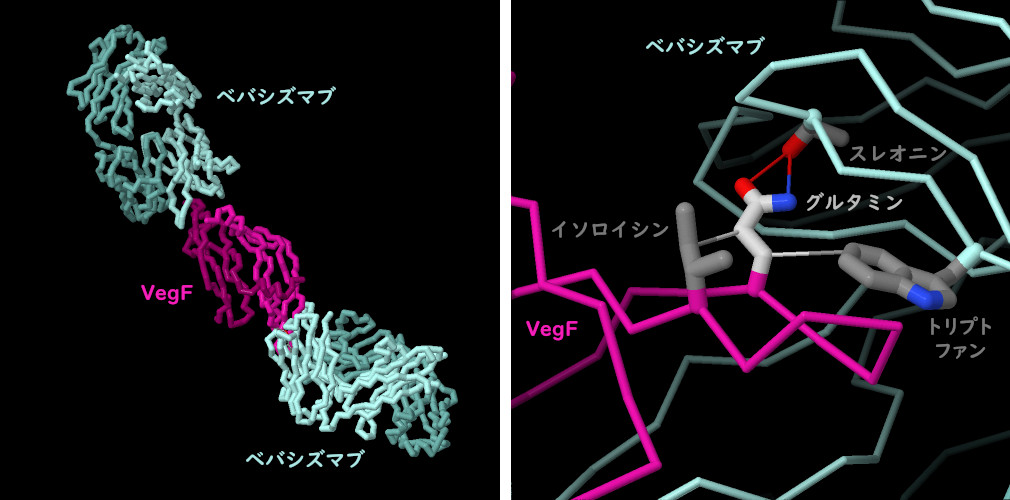
VegFを伴ったベバシズマブの構造(PDBエントリー1bj1)を見ると、2つのベバシズマブ分子がVegFと相互作用し、VegF 2量体(図左)の両端を阻害していることがわかる。このため、受容体は2量体になることができず、血管新生に関する一連の信号伝達を活性化することができない。ほとんどの抗体と同様に、ベバシズマブとVegFの間にも非常に相補性の高い相互作用が形成される。例えば、ベバシズマブとVegFの結合には、グルタミンを中心とした3つの分子間相互作用のセットが不可欠である。これには、隣接するスレオニンとの水素結合相互作用、トリプトファンおよびイソロイシンとの疎水性相互作用が含まれ、グルタミンが適切な配置となるよう押さえつけている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 2021 A structural overview of vascular endothelial growth factors pharmacological ligands: from macromolecules to designed peptidomimetics. Molecules 26 6759
- 5t89 2017 Structure of the full-length VEGFR-1 extracellular domain in complex with VEGF-A. Structure 25 341-352
- 2017 Snake venom VEGF Vammin induces a highly efficient angiogenic response in skeletal muscle via VEGFR-2/NRP specific signaling. Scientific reports 7 5525
- 2015 Targeting angiogenesis in cancer therapy: moving beyond vascular endothelial growth factor. Oncologist 20 660-673
- 2m59 2014 Structural and functional characterization of alternative transmembrane domain conformations in VEGF receptor 2 activation. Structure 22 1077-1089
- 2013 Protein structure in context: the molecular landscape of angiogenesis. Biochemistry and Molecular. Biology Education 41 213-223
- 2010 Bevacizumab. Oncologist 15 819-825
- 1wq8 2005 Crystal structures of novel vascular endothelial growth factors (VEGF) from snake venoms: insight into selective VEGF binding to kinase insert domain-containing receptor but not to fms-like tyrosine kinase-1. Journal of Biological Chemistry 280 2126-2131
- 1bj1 1998 VEGF and the Fab fragment of a humanized neutralizing antibody: crystal structure of the complex at 2.4 Å resolution and mutational analysis of the interface. Structure 6 1153-1167
- 1vpf 1997 Vascular endothelial growth factor: crystal structure and functional mapping of the kinase domain receptor binding site. Proceedings of the National Academy of Sciences 94 7192-7197
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









