267: 血管内皮生长因子和血管生成(Vascular Endothelial Growth Factor (VegF) and Angiogenesis)
本文由Ethan Cartagena,Mariam Gelashvili,Jasmine Keyes和Elizabeth Rosenzweig撰写和插图,是罗格斯定量生物医学研究所(Rutgers Institute for Quantitative Biomedicine)为本科生和研究生举办的为期一周的训练营的一部分。该文章是2022-2023年PDB-101健康重点 "癌症生物学和治疗学 "(Cancer Biology and Therapeutics)中的一篇。
创造新的血管
我们的身体不断地创造新的血管,借此将必要的营养物质分配给所有细胞。癌细胞(cancer cell)利用这个被称为血管生成的过程来生长和转移。血管生成是由信号蛋白血管内皮生长因子(vascular endothelial growth factor,VegF)刺激的,当它释放到血液中时,启动了一个复杂的分子舞蹈,从而在细胞之间形成开口。前体内皮细胞(precursor endothelial cell)可以迁移到这些开口处并创建新血管的内壁。癌细胞,特别是具有最高转移能力的最具侵略性的类型,操纵着血管生成的过程。通过诱导肿瘤中新血管的生长,癌症可以转移其他器官的养分,并在周围组织中创造出一条快速生长和扩散的途径。
配对激活
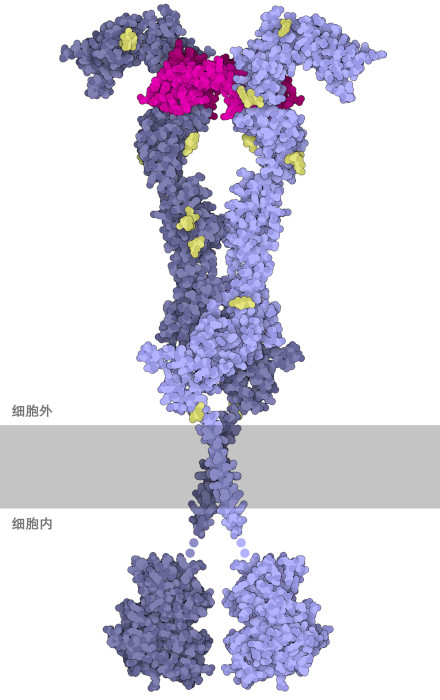
VegF携带启动血管生成的信号,这些信号由VegF细胞受体上的一种称为VegF受体酪氨酸激酶(VegF Receptor tyrosine kinase,VegFR)的跨膜蛋白接收。当处于非活性状态时,受体作为一个单一的单元存在,像漂浮在水中的冰山一样沿着细胞膜移动。然而,当它与 VegF 结合时,它会与自身的另一个副本配对,形成活性二聚体,如图所示。由于受体非常灵活且结构复杂,因此需要三个 PDB 文件来创建此插图:胞外域(extracellular ectodomain,PDB条目5t89)、跨膜域(transmembrane domain,(PDB条目2m59),胞内酪氨酸激酶结构域(intracellular tyrosine kinase domain,PDB条目3hng)。二聚化过程将细胞膜内酪氨酸激酶结构域的两个副本聚集在一起,使它们能够相互激活。活性酪氨酸激酶反过来刺激细胞内的其他信号蛋白。这开始了血管生成所需的许多过程,包括解开粘附结点(adherens junction),如下文所述。
贝伐珠单抗:一把双刃剑
VegF的信号传递是癌症生长的重要一步,它就成为癌症治疗的一个有吸引力的靶点。贝伐珠单抗(Bevacizumab,商品名阿瓦斯丁 Avastin)是一种单克隆抗体(monoclonal antibody),能与VegF结合并阻止其与受体结合。当 VegF 通过与贝伐珠单抗结合而失活时,VegFR 二聚化的速度减慢,进而减慢血管生成的过程。这可以防止氧气和营养物质过快到达肿瘤,并减少癌细胞离开原来的肿瘤并迁移到身体其他部位的机会。然而,虽然用贝伐单抗治疗能有效地抑制癌细胞的生长,但它也会对其他过程造成严重的副作用,例如减缓伤口愈合。
铺设管道
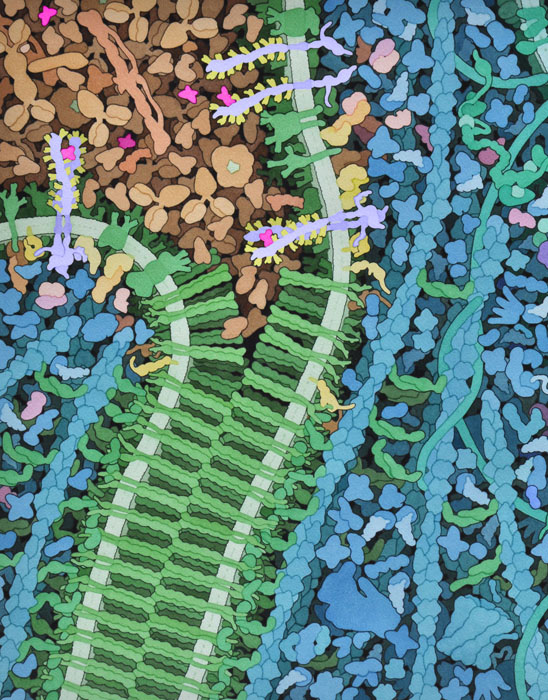
VegF的信号传递是在营养缺乏的条件下开始的,如快速生长的肿瘤所产生的条件,其中缺氧会刺激VegF信号蛋白的产生和释放,这些蛋白通过血浆迁移并与VegFR的外域结合和激活。信号被"传送"过膜,VegFR的激酶域激活了细胞内的各种其他信号传导蛋白。其中一些转移到细胞核并改变参与血管生成的基因的表达。信号蛋白还能使细胞边界的钙粘蛋白(cadherin)的内部部分磷酸化。这促使钙粘蛋白膜的外部部分打开,就像把尼龙搭扣撕成两半一样。前体血管细胞被吸引到开口处并形成新血管的内壁。
伤口愈合
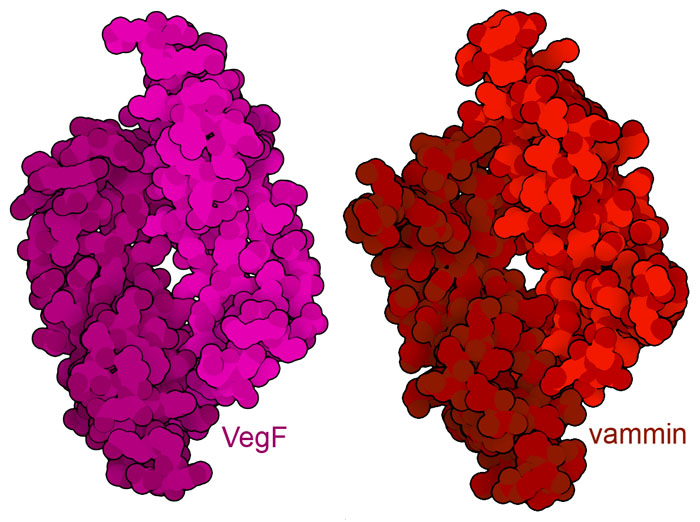
血管生成是控制转移性肿瘤进展的一个重要靶点。然而,在其他情况下,我们可能想要刺激血管生成,以促进伤口愈合等有益过程。研究人员目前正在探索使用模仿 VegF 结构的蛋白质的可能性,从而复制其功能。例如,一种蛋白质vammin(PDB条目1wq8)来自蛇毒,在三维结构和序列上都与VegF(PDB条目1vpf)非常相似,并且与VegF一样,能激活VegF受体。
探索结构
要切换到有互动控制的页面,请点击图表下方的按钮。如果加载没有开始,请尝试点击图表。
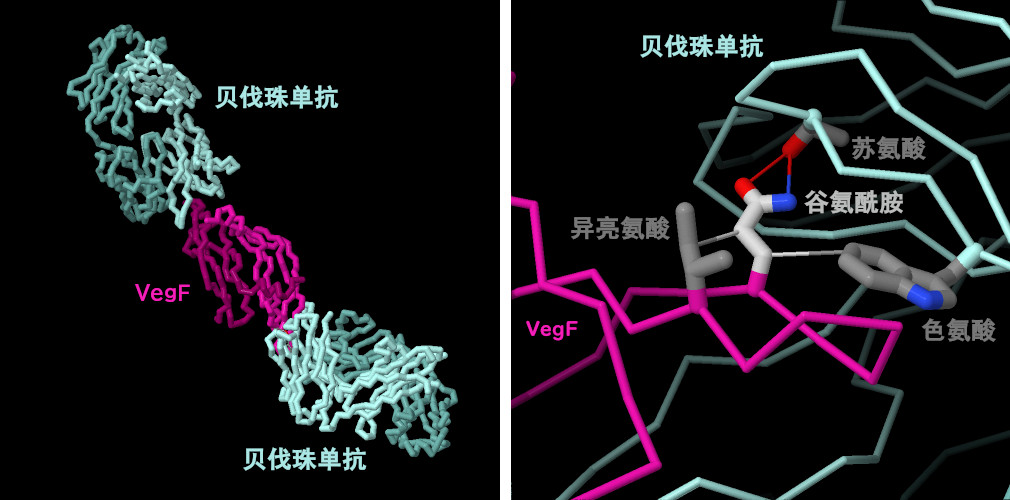
贝伐单抗与VegF的结构(PDB条目1bj1)显示,两个贝伐单抗分子与VegF相互作用,抑制VegF二聚体的两端(图的左侧)。因此,该受体无法二聚并激活一系列与血管生成有关的信号。与大多数抗体一样,贝伐珠单抗和VegF之间形成高度互补的相互作用。例如,以谷氨酰胺为中心的一组三种分子相互作用对于贝伐珠单抗与VegF的结合至关重要。这些包括与相邻的苏氨酸的氢键相互作用,以及与色氨酸和异亮氨酸的疏水作用,这些相互作用将谷氨酰胺限制在正确的构象中。点击图下方的按钮,切换到可操作的交互式图像,以更详细地了解这一结构。
进一步的讨论议题
参考文献
- 2021 A structural overview of vascular endothelial growth factors pharmacological ligands: from macromolecules to designed peptidomimetics. Molecules 26 6759
- 5t89 2017 Structure of the full-length VEGFR-1 extracellular domain in complex with VEGF-A. Structure 25 341-352
- 2017 Snake venom VEGF Vammin induces a highly efficient angiogenic response in skeletal muscle via VEGFR-2/NRP specific signaling. Scientific reports 7 5525
- 2015 Targeting angiogenesis in cancer therapy: moving beyond vascular endothelial growth factor. Oncologist 20 660-673
- 2m59 2014 Structural and functional characterization of alternative transmembrane domain conformations in VEGF receptor 2 activation. Structure 22 1077-1089
- 2013 Protein structure in context: the molecular landscape of angiogenesis. Biochemistry and Molecular. Biology Education 41 213-223
- 2010 Bevacizumab. Oncologist 15 819-825
- 1wq8 2005 Crystal structures of novel vascular endothelial growth factors (VEGF) from snake venoms: insight into selective VEGF binding to kinase insert domain-containing receptor but not to fms-like tyrosine kinase-1. Journal of Biological Chemistry 280 2126-2131
- 1bj1 1998 VEGF and the Fab fragment of a humanized neutralizing antibody: crystal structure of the complex at 2.4 Å resolution and mutational analysis of the interface. Structure 6 1153-1167
- 1vpf 1997 Vascular endothelial growth factor: crystal structure and functional mapping of the kinase domain receptor binding site. Proceedings of the National Academy of Sciences 94 7192-7197
 生物大分子学习的教育门户
生物大分子学习的教育门户 









