268: HER2/neuとトラスツズマブ(HER2/neu and Trastuzumab)
この記事は、定量生物医学ラトガース研究所(Rutgers Institute for Quantitative Biomedicine)の主催で開催された1週間の大学生・大学院生向け集中合宿の一環として、ソル・デ・リオン・クルーズ(Sol De Leon Cruz)、アンバー・ヘロッド(Amber Herrod)、キャサリン・H・パーク(Katherine H. Park)、エイミー・ウーウー(Amy Wu-Wu) により執筆され、描かれたもので、2022-2023年 PDB-101の健康フォーカス「がん生物学と治療法」(Cancer Biology and Therapeutics)の一部としても掲載されています。
乳がん(breast cancer)は、世界の女性死亡原因でがんに関連するものの中では第1位になっている。周囲に広がっていく浸潤性乳がんの約20%には、ヒト上皮成長因子受容体2(human epidermal growth factor receptor 2、HER2、neu または ErbB2 とも呼ばれる)が過剰に存在している。この状態は、HER2遺伝子が自身のコピーをたくさん作り過ぎ(HER2遺伝子増幅、HER2 gene amplification)、HER2受容体の過剰産生(HER2タンパク質の過剰発現)につながると起きることがある。HER2を過剰に持つ患者は、乳がん細胞の増殖や分裂を制御できないため、生存率が低下し、化学療法やホルモン療法に対する反応も悪くなる。HER2の作用機序と立体構造を理解することは、こうした問題に対処するための新しい効果的な治療法の発見に役立っている。
独特なタイプの台頭
HER2は、4種類あるチロシンキナーゼ受容体(tyrosine kinase receptor、HER1、HER2、HER3、HER4)のグループ(ファミリー)に属する受容体で、身体中にある多くの細胞で細胞膜に埋め込まれている。通常これらの受容体は、細胞の成長や増殖、代謝、生存、分化などの重要な生物学的過程を制御している。HER受容体がとる構造は、テザー型(tethered)と伸長型(extended)の2種類がある。テザー型の場合、タンパク質は折りたたまれていて、同種の受容体や他の型の受容体と結合することはできない。一方、開いた伸長型は、リガンドと相互作用することによって形成されるもので、自由に複合体をつくり信号を伝達することができる。HER2はこの種のチロシンキナーゼの中では独特で、リガンドを必要とすることなく常に伸長型の構造をとる。この特徴は結合相手にとって理想的であり、腫瘍形成に大きく貢献している。正常な信号伝達経路の場合、HER2は他のタイプのHER受容体と複合体を形成していることが多い。ところががん細胞ではHER2の濃度が高いため、他のHER受容体との間に形成される通常の複合体だけでなく、HER2同士で構成される活性型2量体もつくられ、細胞に対して繁殖を促すより強い信号が送られることになる。
HER2を標的にする
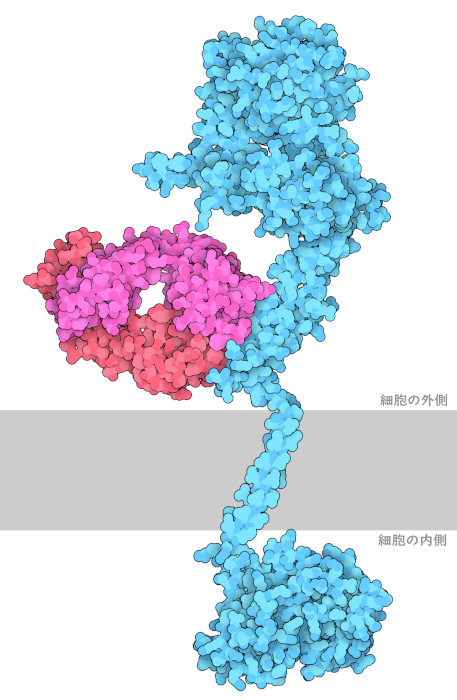
HER2の構造を解明することは、乳がんに効果のある新しい治療法を発見するのに役立つ。実験室で作られたモノクローナル抗体のトラスツズマブ(Trastuzumab)は、FDA(米国食品医薬品局)が承認したHER2を標的とした治療薬である。トラスツズマブはHER2受容体に結合して、ホモ2量体化するのを阻害する。これにより、細胞の増殖や複製が抑えられ、最終的にHER2陽性乳がんの増殖を遅らせることができる。ここに示す図は3つのPDBエントリーで構成されている。トラスツズマブのFab部分を伴った細胞外ドメインは1n8z、細胞内側のキナーゼドメインは3pp0、膜貫通ドメインは2ks1の構造である。しかし残念ながら、このような臨床的有用性があるにもかかわらず、投与後にしばしば耐性を獲得してしまうため、トラスツズマブによる全体的な効果は限定的である。
耐性への取り組み
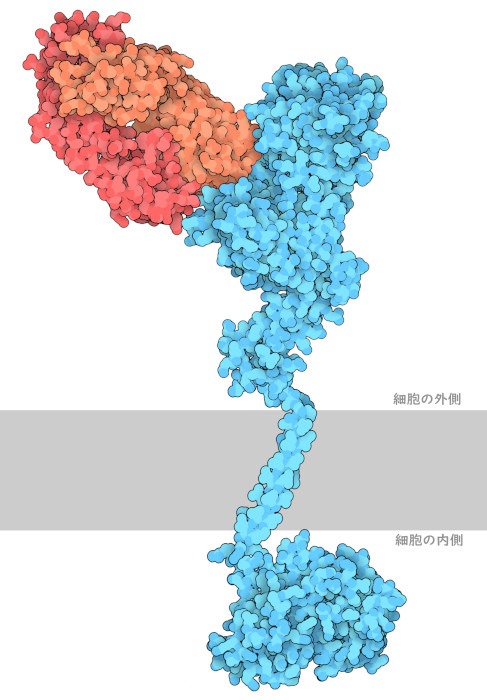
トラスツズマブによって、HER2陽性乳がん患者の予後(病気の経過に関する見通し)は劇的に改善した。しかし、HER2陽性乳がん患者の約50〜60%が耐性を獲得し、抗体が効かなくなる。この問題に対処するため、同じようにHER2を標的とするが方法は異なる新しい抗体ペルツズマブ(Pertuzumab)が導入されている。PDBエントリー1s78で見られるように、この抗体は膜から離れた分子上部に結合し、HER2が他のHER受容体とヘテロ2量体を形成するときに使う結合ポケットを阻害する。ペルツズマブは特に、発がんにおいて重要な役割を果たすHER2:HER3複合体の形成を阻害する。ペルツズマブもFDAの承認も受けていて、HER2信号伝達に関する一連の経路をその発生元で阻害することにより、特に以前の治療では効果が上がらなかった患者において、全体の生存率を高めより良い効果を上げることに役立っている。
構造をみる
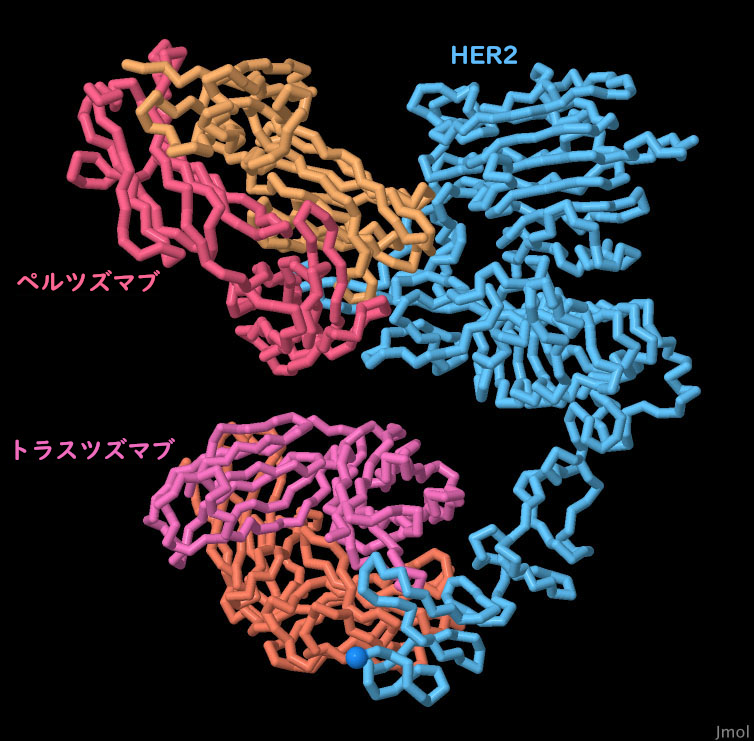
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
2種類の治療用抗体が利用できることには大きな利点がある。トラスツズマブとペルツズマブを同時に使う方法はデュアルHER2阻害(Dual-HER2 inhibition)として知られているが、この治療法を使うことによりトラスツズマブ耐性を克服することができる。また患者が耐性を持ってしまうのを抑えるのにも役立つかもしれない。ここに示すPDBエントリー6ogeの構造からもわかるように、HER2が2つの異なる場所で攻撃されると、タンパク質を変異させて両方の治療薬に対し同時に耐性を持つのはより難しくなる。さらに、この併用療法は、乳がんの進行に寄与するHER2の機能をいくつも標的とすることにも役立っている。トラスツズマブ単独では、ホモ2量体化を阻害するが、HER2ヘテロ2量体化に関わる腕は機能したままである。一方、ペルツズマブはヘテロ2量体化を阻害する能力を持っている。この併用療法により、細胞増殖の阻止(トラスツズマブ)とHER2:HER3の活性化阻止(ペルツズマブ)という両方の恩恵にあずかることができる。抗HER2薬の二重投与は、単独での投与に比べ、患者の治療経過を著しく改善することが示されている。画像の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造についてより詳しく見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 6oge 2019 Cryo-EM Structure of HER2-trastuzumab-pertuzumab complex. PLoS One. 14(5) e0216095
- 2018 Effect of VH-VL Families in Pertuzumab and Trastuzumab Recombinant Production, Her2 and FcγIIA Binding. Front Immunol. 9 469
- 2014 The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacol Res. 79 34-74
- 2012 Maximizing human epidermal growth factor receptor 2 inhibition: a new oncologic paradigm in the era of targeted therapy. J Clin Oncol. 30(14) 1712-1714
- 3pp0 2011 Structural analysis of the mechanism of inhibition and allosteric activation of the kinase domain of HER2 protein. J Biol Chem. 286(21) 18756-65
- 2011 Hallmarks of cancer: the next generation. Cell. 144(5) 646-674
- 2011 Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clin Cancer Res. 17(20) 6437-47
- 2ks1 2010 Spatial structure of the transmembrane domain heterodimer of ErbB1 and ErbB2 receptor tyrosine kinases. J Mol Biol. 400(2) 231-43
- 2007 Trastuzumab--mechanism of action and use in clinical practice. N Engl J Med. 357 39-51
- 1s78 2004 Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5(4) 317-28
- 1n8z 2003 Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab. Nature. 421(6924) 756-60
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









