267: 혈관내피 증식인자와 혈관형성 (Vascular Endothelial Growth Factor (VegF) and Angiogenesis)
이 기사는 정량 생물 의학 라트가스 연구소 (Rutgers Institute for Quantitative Biomedicine)의 주최로 개최된 1주일간의 대학생·대학원생을 위한 집중 합숙의 일환으로 에단 카르타헤나(Ethan Cartagena), 마리암 제라시빌리(Mariam Gelashvili), 재스민 키스(Jasmine Keyes), 엘리자베스 로젠스와이그(Elizabeth Rosenzweig)에 의해 집필되고 그려진 것으로, 2022-2023년 PDB-101의 건강 포커스 「암 생물학과 치료법」( Cancer Biology and Therapeutics)의 일부로도 게재되고 있습니다.
새로운 혈관 만들기
우리 몸은 끊임없이 새로운 혈관을 만들고 모든 세포에 필요한 영양을 전달합니다. 암세포(cancer cell)는 이와 같은혈관형성(angiogenesis)이라 불리는 프로세스를 이용하여 증식·전이됩니다. 혈관형성은 신호전달 단백질인 혈관내피증식인자(vascular endothelial growth factor, VegF)에 의해 자극됩니다. VegF가 혈류로 방출되면 복잡한 분자 댄스가 시작되고 세포 사이에 개구부가 생기게 됩니다. 전구 내피 세포(precursor endothelial cell)는 이 개구부로 이동하여 새로운 혈관의 내벽을 만듭니다. 암세포, 특히 전이능력이 가장 높고 공격적인 타입의 암세포는 혈관형성의 과정을 조작합니다. 종양에 이르는 새로운 혈관의 성장을 유도함으로써 암은 다른 장기로 보내지는 영양을 돌려 암 주변 조직에 영양을 끌어오는 경로를 만들어 급속하게 성장하고 전이할 수 있습니다.
페어를 만들어서 활성화
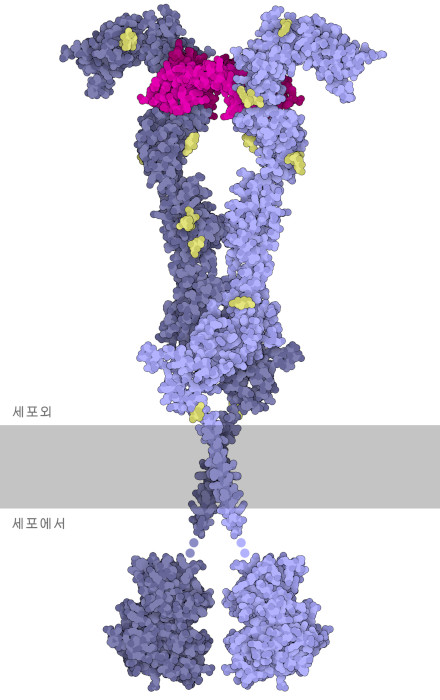
VegF는 혈관형성을 개시하기 위한 신호를 전달하고, VegF의 세포 수용체이며 VegF 수용체 티로신 키나제(VegF Receptor tyrosine kinase, VegFR)로 불리는 막관통 단백질에 의해 수신됩니다. 비활성 상태에 있을 때, 수용체는 단일 유닛으로서 존재하고, 물 속에 떠 있는 빙산과 같이 세포막을 따라 이동합니다. 그런데 VegF가 결합하면, 또 다른 수용체 분자와 페어가 되어 활성이 있는 이량체가 됩니다. 여기에 나타나 있는 것은 활성형 이량체입니다. 수용체는 매우 유연하고 구조적으로 복잡하기 때문에이 그림을 작성하려면세포외부에 있는 외부도메인 (extracellular ectodomain, PDB 항목 5t89), 막 관통 도메인(transmembrane domain, PDB 엔트리 2m59), 세포 내에 있는 티로신 키나제 도메인(intracellular tyrosine kinase domain, PDB 엔트리3hng)이라는 3개의 PDB 구조 데이터가 필요했습니다. 이량체화는 세포막 내부에 있는 두 개의 티로신 키나제 도메인을 모아 서로를 활성화시킵니다. 그리고 활성화된 티로신 키나제는 차례로 세포내에 있는 다른 신호전달 단백질을 자극하고, 아래에서 기술하는접착 결합(adherens junction)의 해리 등, 혈관형성에 필요한 다양한 과정을 개시합니다.
베바시주맙: 양날의 검
VegF에 의한 신호 발신은 암 증식에 중요한 단계이기 때문에 암 치료에 유력한 표적이 됩니다. 베바시주맙(Bevacizumab, 상품명 아바스틴 Avastin)은 VegF에 결합하여 수용체와의 결합을 방해하는 모노클로날 항체(monoclonal antibody)입니다. VegF가 베바시주맙과 결합하여 불활성화되면, VegFR이 이량체화되는 속도가 느려지고 혈관형성 과정을 지연시킬 수 있습니다. 이것으로 산소와 영양이 종양에 빨리 도달하는 것을 방지함과 동시에 암세포가 원래의 종양에서 이탈하여 신체의 다른 곳으로 이동하는 기회를 줄일 수 있습니다. 그러나 베바시주맙에 의한 치료는 암세포의 증식을 억제하는 효과가 있는 한편, 상처의 치유(창상치유)를 지연시키는 등 다른 과정에서 심각한 부작용을 일으킬 가능성도 있습니다.
파이프라인을 정렬
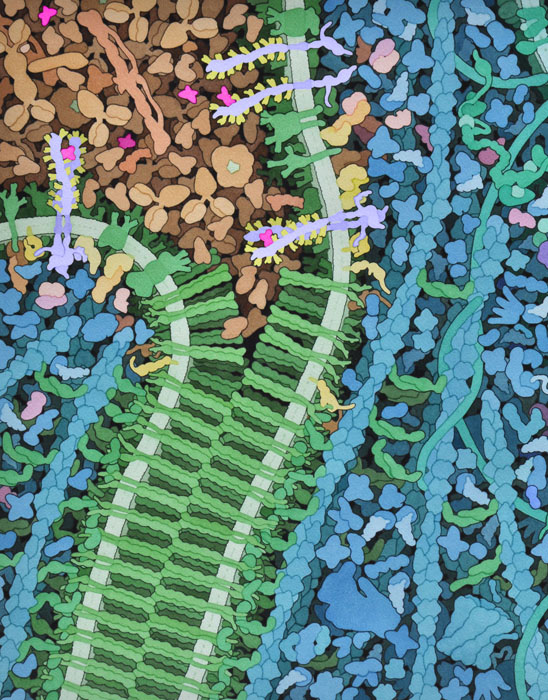
VegF에 의한 신호는 빠르게 성장하는 종양이 생성되는 영양 부족 조건 하에서 시작되며, 산소 부족으로 VegF 신호 전달 단백질의 생성과 방출이 촉진됩니다. VegF 단백질은 혈장 내에서 이동하고 VegFR의 외부 도메인에 결합하여 이것을 활성화시킵니다. 신호는 막을 넘어서 "전달"되고 VegFR의 키나제 도메인은 세포 내의 다양한 다른 신호 전달 단백질을 활성화시킵니다. 이들 중 일부는 핵으로 이동하여 혈관형성에 관여하는 유전자의 발현을 변화시킵니다. 또한, 이 신호전달 단백질은 세포의 경계면에 있는 카데린(cadherin) 단백질의 세포내 부분을 인산화합니다. 이것은 벨크로 테이프(찍찍이 테이프)를 잡아당겨 두 부분으로 나누는 것처럼 카데린의 막 외부 부분을 여는 데 도움이됩니다. 혈관의 전구 세포는이 개구부에 이끌려 새로운 혈관의 내막을 형성합니다.
상처치유
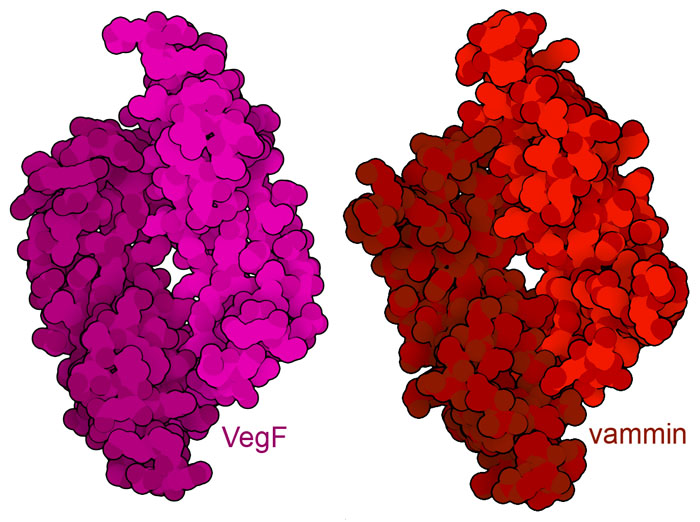
혈관형성은 전이성 종양의 진행을 억제하기 위한 중요한 표적입니다. 그러나 상처를 치료하는 등 유익한 과정을 촉구하기 위해 혈관형성을 촉구를 생각하는 경우도 있습니다. 현재 VegF의 구조를 모방하여 그 기능을 복제한 단백질의 사용여부를 찾는 연구가 진행되고 있습니다. 예를 들어, 뱀의 독에서 유래된 단백질 중 하나 바민(vammin, PDB 엔트리1wq8)은 VegF(PDB 엔트리1vpf)에 비교하여 입체 구조와 서열의 양면 에서 매우 유사하며 VegF와 마찬가지로 VegF 수용체의 활성화를 유도합니다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
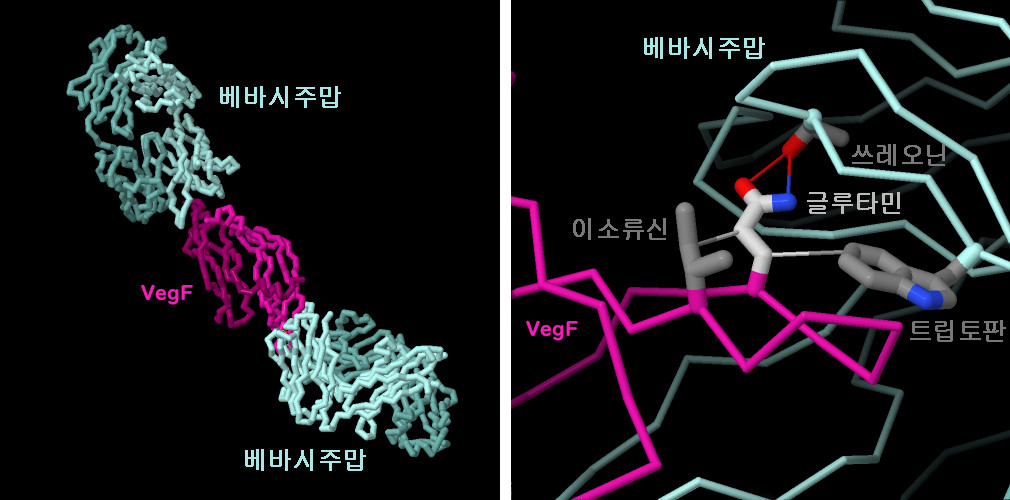
VegF과 이용한 베바시주맙의 구조(PDB 엔트리1bj1)를 보면, 2개의 베바시주맙 분자가 VegF와 상호작용하여, VegF 이량체(그림 왼쪽)의 양 끝을 차단하고 있는 것을 알수 있습니다. 이 때문에, 수용체는 이량체가 될 수 없고, 혈관형성에 관한 일련의 신호전달이 활성화할 될수 없습니다. 대부분의 항체와 마찬가지로, 베바시주맙과 VegF 사이에도 상보성이 높은 상호작용이 형성됩니다. 예를 들어, 베바시주맙과 VegF의 결합에는 글루타민을 중심으로 한 세 가지 분자간 상호작용의 집합이 필수적입니다. 여기에는 인접한 트레오닌과의 수소 결합 상호작용, 트립토판 및 이소로이신과의 소수성 상호작용이 포함되며, 글루타민이 적절한 배치가 되도록 제한됩니다. 이 구조를 더 자세히 보고 싶으시면, 이미지를 클릭해 주세요.
이해를 높이기 위한 토픽
- 혈관형성을 유도하는 경로에는 높은 수준의 중복성과 상호작용이 존재합니다. 다른 경로의 신호 분자를 알아보기 위하여 혈소판 유래 성장 인자(platelet-derived grown factor, PDB 엔트리6t9e)나 섬유아세포 성장 인자(fibroblast growth factor, PDB 엔트리[ [PDB:1qql]])를 찾아보는 것에서부터시작해 보세요.
- 이량체화는 수용체를 활성화하는 방식으로 잘 알려져 있습니다. 상피 성장인자(epidermal growth factor) 문서를 참조하여 다른 예를 확인해 보세요.
참고문헌
- 2021 A structural overview of vascular endothelial growth factors pharmacological ligands: from macromolecules to designed peptidomimetics. Molecules 26 6759
- 5t89 2017 Structure of the full-length VEGFR-1 extracellular domain in complex with VEGF-A. Structure 25 341-352
- 2017 Snake venom VEGF Vammin induces a highly efficient angiogenic response in skeletal muscle via VEGFR-2/NRP specific signaling. Scientific reports 7 5525
- 2015 Targeting angiogenesis in cancer therapy: moving beyond vascular endothelial growth factor. Oncologist 20 660-673
- 2m59 2014 Structural and functional characterization of alternative transmembrane domain conformations in VEGF receptor 2 activation. Structure 22 1077-1089
- 2013 Protein structure in context: the molecular landscape of angiogenesis. Biochemistry and Molecular. Biology Education 41 213-223
- 2010 Bevacizumab. Oncologist 15 819-825
- 1wq8 2005 Crystal structures of novel vascular endothelial growth factors (VEGF) from snake venoms: insight into selective VEGF binding to kinase insert domain-containing receptor but not to fms-like tyrosine kinase-1. Journal of Biological Chemistry 280 2126-2131
- 1bj1 1998 VEGF and the Fab fragment of a humanized neutralizing antibody: crystal structure of the complex at 2.4 Å resolution and mutational analysis of the interface. Structure 6 1153-1167
- 1vpf 1997 Vascular endothelial growth factor: crystal structure and functional mapping of the kinase domain receptor binding site. Proceedings of the National Academy of Sciences 94 7192-7197
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









