266: オリゴ糖転移酵素(Oligosaccharyltransferase)
ほとんどすべての生きた細胞は、糖質(carbohydrate)の複雑な被膜で覆われている。これらの糖質は、細胞膜を構成するタンパク質や脂質と結びついている。糖質は、数種類の単糖が無数の異なる方法で結合してできている。この糖鎖被膜は、細胞が生きていく上で重要となるさまざまな役割を担っている。例えばある構造の場合、糖質はかさばっていて、細胞表面へのアクセスを制御する保護シールドを形成している。血清タンパク質のような分泌タンパク質は、しばしばグリコシル化(glycosylated、糖鎖付加)され、これにより溶解性と安定性が向上している。糖鎖はまた、形や大きさにいくつかの種類があって、通常は生物ごとに特徴が違う糖鎖群を持っている。ABO式血液型(ABO blood types)は、私たち自身が持つ細胞の表面におけるグリコシル化で見られる個人差の身近な一例で、輸血などの医療行為を行う際、自分の糖鎖パターンとは異なるドナーを使うことがないようにしなければならない。
タンパク質を糖化する
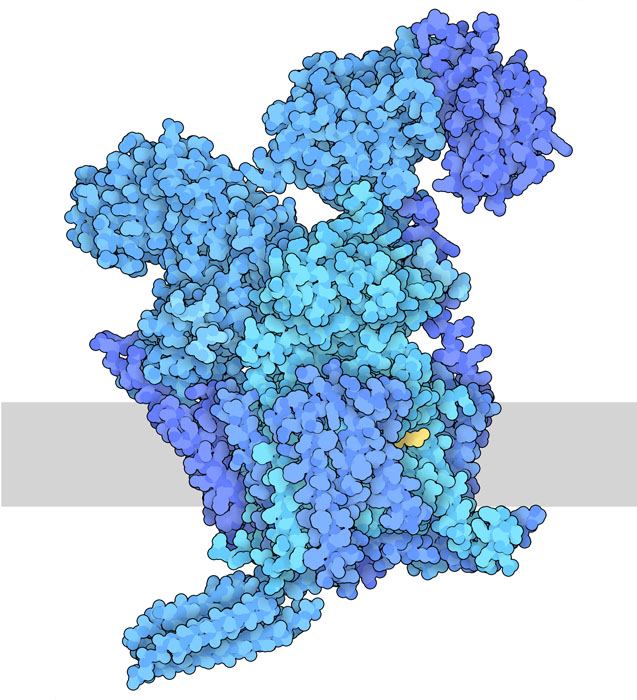
糖鎖は、セリン(serine)やスレオニン(threonine)の酸素原子に結合する方法(O-グリコシル化、O-glycosylation)と、アスパラギン(asparagine)の窒素に結合する方法(N-グリコシル化、N-glycosylation)の2種類でタンパク質に結合することが最も一般的である。N-グリコシル化反応はオリゴ糖転移酵素(oligosaccharyltransferase)が行う。私たちの細胞は、この酵素の類似形を2種類~OST-A(ここに示すのはPDBエントリー6s7o)とOST-B(PDBエントリー6s7t、ここには示していない)~を作っている。まず、さまざまな酵素の集合体が、脂質でできた置き場の上に糖鎖を1つ1つ構築していく。次に、オリゴ糖転移酵素が、その名の通り、脂質からタンパク質上のアスパラギンアミノ酸に糖鎖を転移する。私たちの細胞の場合、この糖鎖の転移は小胞体(endoplasmic reticulum)で行われ、糖鎖は小胞体とゴルジ体(Golgi apparatus, Golgi body)にある別の酵素によってさらに修飾され整えられる。こうしてつくられた糖タンパク質は、細胞表面に運ばれるか、または細胞の外に排出されることになる。
ウイルスと多糖類
私たちは常にウイルスと綱引きをし、糖タンパク質を巡り戦っている。ウイルスは細胞を見つけて感染する必要があり、細胞表面にある糖鎖は細胞がウイルスから物理的に身を守る方法の一つになっている。しかし、ウイルスはこの防御策を回避するために進化してきた。例えば、インフルエンザウイルスは赤血球凝集素(hemagglutinin、ヘマグルチニン)分子を使って細胞表面にある糖分子を認識し、感染の際に利用する。私たちの免疫システムもこの戦いに巻き込まれている。本来備わっている免疫系(intrinsic immune system)は、病原体表面にある見慣れない糖鎖を認識する。例えば、細菌表面にある糖脂質のように細胞にとっては珍しいものが認識対象となる。しかし、ヒト免疫不全ウイルス(Human Immunodeficiency Virus、HIV)やSARSコロナウイルス2型(SARS-CoV-2)のような生命を脅かすウイルスは、私たちの免疫システムを回避するため、自らをヒトに似た糖鎖でコーティングしている。
OST-Aが活動する様子
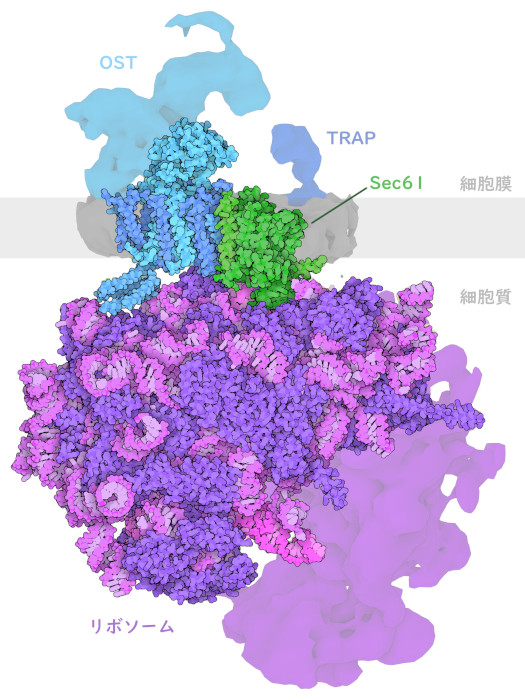
オリゴ糖転移酵素Aは、タンパク質合成装置と連携し、タンパク質が作られるときに糖鎖を付加する。ここに示した構造(PDBエントリー6fti)は、転移反応後の過程における一段階を示している。リボソーム(ribosome)がタンパク質鎖を構築し、これがタンパク質伝導チャネルSec61によって小胞体に輸送される。オリゴ糖転移酵素は、適切なアスパラギンの場所で新しいタンパク質鎖に対し糖鎖を付加する。この酵素は、タンパク質配列中の特徴的なパターンを認識し、鎖の中で隣がプロリンではなく、2つ後ろのアミノ酸がセリンまたはスレオニンになっているアスパラギンに糖鎖を付加する。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
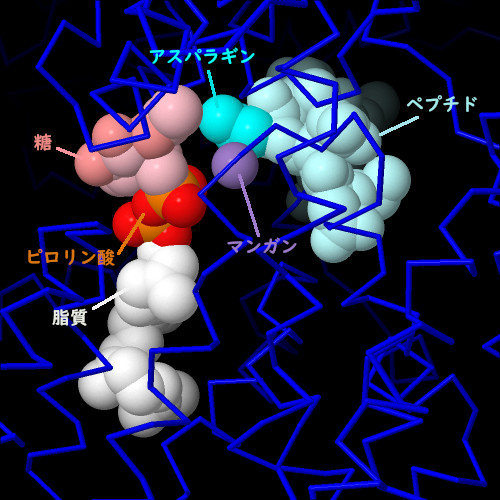
細菌が持つより単純なオリゴ糖転移酵素(PDBエントリー5ogl)を見ると、糖鎖転移反応の詳細がわかる。糖鎖は、糖鎖の化学反応を活性化するピロリン酸(pyrophosphate)を介して脂質に結合する。酵素は受容体となるアスパラギンを糖鎖の近くに配置する。この2つの分子を結合させ、分子間の反応を触媒するには、近くに2価の金属イオンが必要となる。画像の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- 糖タンパク質の構造が多数PDBに登録されています。N-グリコシル化されたタンパク質を見るには、RCSB PDBの詳細検索でStructure Attribute->Glycosylation Site-> N-Glycosylationを選択して検索してみてください。
- 糖質についてより良く学びPDBアーカイブでそれらをどうやって見ればいいのかを知るには、RCSB PDBのPDB-101にあるPDBアーカイブで糖質を見る(Exploring Carbohydrates in the PDB Archive、英語)を参照してみてください。
参考文献
- 6s7o 2019 Cryo-electron microscopy structures of human oligosaccharyltransferase complexes OST-A and OST-B. Science 366 1372-1375
- 6fti 2018 Structural basis for coupling protein transport and N-glycosylation at the mammalian endoplasmic reticulum. Science 360 215-219
- 6ogl 2017 Molecular basis of lipid-linked oligosaccharide recognition and processing by bacterial oligosaccharyltransferase. Nat Struct Mol Biol 24 1100-1106
- 2017 Biological roles of glycans. Glycobiology 27 3-49
- 2006 Glycosylation in cellular mechanisms of health and disease. Cell 126 855-867
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









