286: 人類呼吸道合胞病毒(RSV Fusion Glycoprotein)
疫苗是對抗病毒性疾病的最有力的醫學工具之一,其工作原理如下:透過提供我們病毒片段,刺激我們的免疫系統產生能識別病毒片段的抗體,為最終真正的病毒侵襲做好準備。然而,在許多情況下,疫苗的成功與否關鍵取決於選擇哪一種病毒分子。早期的疫苗,如脊髓灰质炎(polio)疫苗和天花(smallpox)疫苗,使用的是滅活的全病毒或危險性較低的病毒近親的簡單方法。目前的方法更具針對性,只選擇病毒中最有效的部分來製作疫苗。結構生物學有助於調整這些疫苗分子,使其發揮最大效力。
人類呼吸道合胞病毒
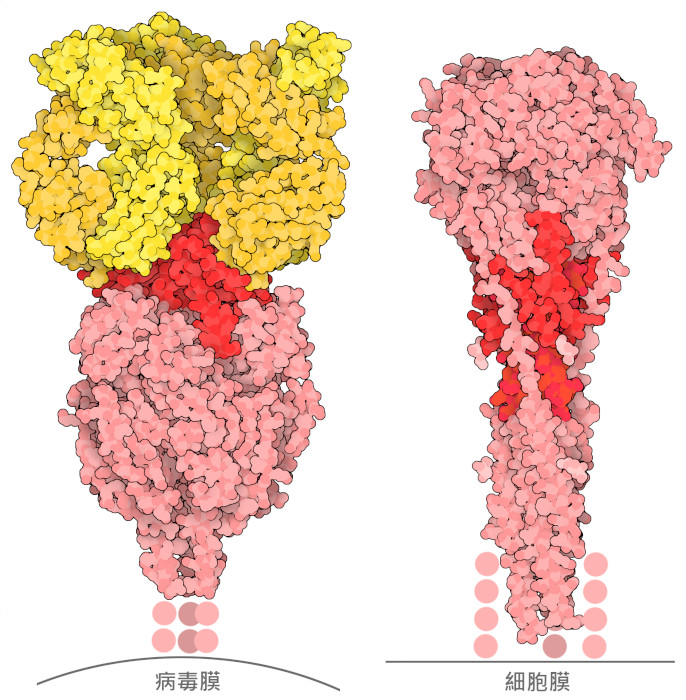
RS病毒(呼吸道合胞病毒,respiratory syncytial virus,RSV)會導致嬰兒和老人出現危及生命的呼吸道感染,長期以來,研究人員一直致力於開發疫苗來預防這種病毒的感染。疫苗研發的重點主要集中在病毒的融合糖蛋白。這種糖蛋白在病毒表面形成突刺,使病毒能夠找到並侵入其感染的細胞。融合糖蛋白是很有吸引力的疫苗靶點,因為抗體很容易接觸到它們,阻斷它們可以阻止病毒附著在細胞上。然而,融合糖蛋白也是一個困難的靶標,因為它們在感染過程中會發生非常大的構象變化:如PDB 條目4jhw 所示,病毒表面的"融合前" 形狀是一個緊湊的三聚體。上側的幾個環(此處顯示為暗紅色)很容易被抗體接觸到,並構成主要的抗原位點。當病毒附著在細胞上時,三聚體會彈開並插入細胞膜。這就在病毒和細胞之間架起了橋樑。隨後,整個蛋白質發生重大重排,最終形成PDB 條目3rrr 中的"融合後" 形式。從這個結構可以看出,所有東西的位置都不同了,主要的抗原位點被埋在了蛋白質的中間,使得抗體基本上無法進入。
疫苗的設計
針對RS 病毒的疫苗設計取得了重大進展,設計出了一種融合糖蛋白,這種糖蛋白可以改變這些結構,並將它們粘合在一起,使其具有融合前的形狀。這種人工設計的蛋白質模仿了傳染性病毒的形狀,從而刺激免疫系統集中攻擊病毒。這個想法被發展成RS 病毒疫苗(Alexby 和Abrysvo),美國食品藥物管理局(US Food and Drug Administration)剛剛批准將其作為保護老年人免受RS 病毒感染和防止新生兒在懷孕期間受到感染的疫苗。目前保護我們免受SARS-CoV-2 感染的mRNA 疫苗也採用了類似的方法。這種疫苗利用融合前處於穩定狀態的病毒尖峰蛋白來刺激免疫系統。
協助免疫系統
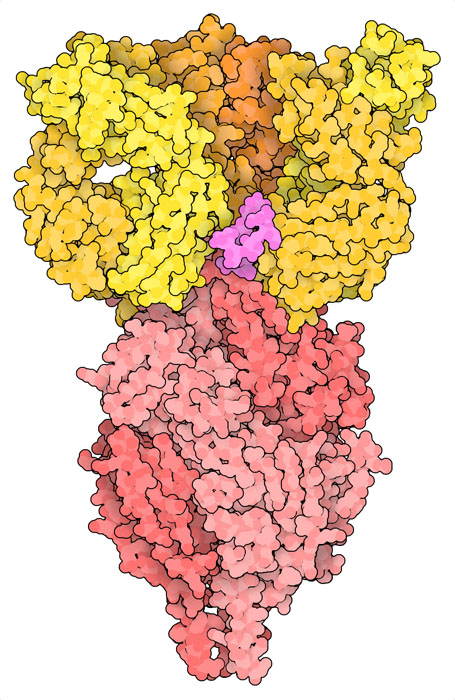
醫學界正在使用補充方法來保護特別易感染的嬰兒免受RS 病毒感染。在這些情況下,注射抗RS病毒的抗體可提供抵抗病毒的第一道屏障。這些抗體與疫苗誘發的抗體相似,且能與融合前病毒表面的融合糖蛋白結合。 PDB條目5udc的結構顯示了抗體治療nirsevimab(尼塞韋單抗)的作用原理。
探索結構
若要切換到有互動控制的頁面,請點擊圖表下方的按鈕。如果載入沒有開始,請嘗試點擊圖表。
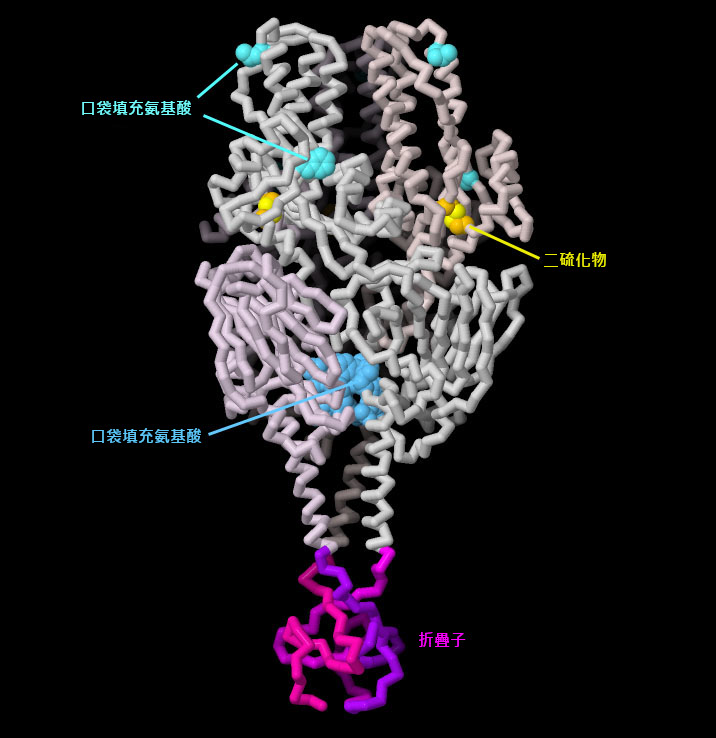
PDB 4mmv 的結構包含融合前處於穩定狀態的人類呼吸道合胞病毒 設計技術的原理驗證研究。此蛋白質包含若干修飾以穩定蛋白質。在融合前狀態下非常靠近的兩個胺基酸之間增加了一個二硫鍵,但在融合後狀態下,這兩個胺基酸被置於蛋白質的兩側。一些胺基酸經過修飾,以填充小的空隙,從而進一步穩定了前融合型蛋白質。最後,一個短片段被加到鏈的末端,形成一個"折疊子"(foldon),將三個鏈緊密結合在一起。點擊圖表下方的按鈕,切換到互動式圖片,查看該結構的更多細節。
進一步的討論議題
- 有關RS 病毒和抗RS 病毒感染治療方法的更多信息,請訪問美國疾病管制中心。
參考文獻
- 2021 RCSB Protein Data Bank resources for structure-facilitated design of mRNA vaccines for existing and emerging viral pathogens. Structure 29 1-14
- 5udc 2017 A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med 9 eaak1928
- 4mmv 2013 Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science 342 592-598
- 4jhw 2013 Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody. Science 340 1113-1117
- 3rrr 2011 Structure of respiratory syncytial virus fusion glycoprotein in the postfusion conformation reveals preservation of neutralizing epitopes. J Virol 85 7788-7796
 生物大分子學習的教育門戶
生物大分子學習的教育門戶 









