286: 人類呼吸道合胞病毒(RSV Fusion Glycoprotein)
疫苗是抗击病毒性疾病的最有力的医学工具之一,其工作原理如下:通过给我们提供病毒片段,刺激我们的免疫系统产生能识别病毒片段的抗体,为最终真正的病毒侵袭做好准备。然而,在许多情况下,疫苗的成功与否关键取决于选择哪种病毒分子。早期的疫苗,如脊髓灰质炎(polio)疫苗和天花(smallpox)疫苗,使用的是灭活的全病毒或危险性较低的病毒近亲的简单方法。目前的方法更具针对性,只选择病毒中最有效的部分来制作疫苗。结构生物学有助于调整这些疫苗分子,使其发挥最大效力。
人類呼吸道合胞病毒
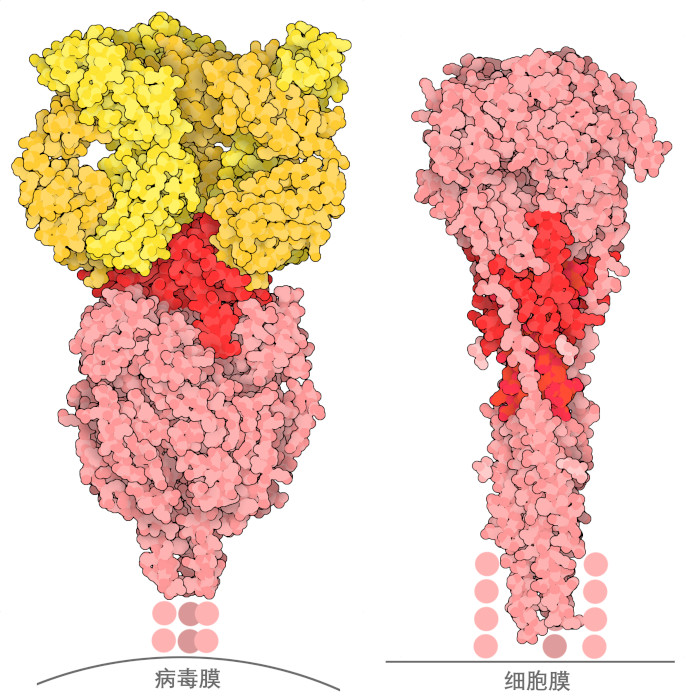
RS病毒(呼吸道合胞病毒,respiratory syncytial virus,RSV)会导致婴儿和老人出现危及生命的呼吸道感染,长期以来,研究人员一直致力于开发疫苗来预防这种病毒的感染。疫苗研发的重点主要集中在病毒的融合糖蛋白上。这种糖蛋白在病毒表面形成突刺,使病毒能够找到并侵入其感染的细胞。融合糖蛋白是很有吸引力的疫苗靶点,因为抗体很容易接触到它们,阻断它们可以阻止病毒附着在细胞上。然而,融合糖蛋白也是一个困难的靶标,因为它们在感染过程中会发生非常大的构象变化:如 PDB 条目 4jhw 所示,病毒表面的 "融合前" 形状是一个紧凑的三聚体。上侧的几个环(此处显示为暗红色)很容易被抗体接触到,并构成主要的抗原位点。当病毒附着在细胞上时,三聚体弹开并插入细胞膜。这就在病毒和细胞之间架起了桥梁。随后,整个蛋白质发生重大重排,最终形成 PDB 条目 3rrr 中的 "融合后 " 形式。从这个结构中可以看出,所有东西的位置都不同了,主要的抗原位点被埋在了蛋白质的中间,使得抗体基本上无法进入。
疫苗的设计
针对 RS 病毒的疫苗设计取得了重大进展,设计出了一种融合糖蛋白,这种糖蛋白可以改变这些结构,并将它们粘合在一起,使其具有融合前的形状。这种人工设计的蛋白质模仿了传染性病毒的形状,从而刺激免疫系统集中攻击病毒。这一想法被发展成 RS 病毒疫苗(Alexby 和 Abrysvo),美国食品药品管理局(US Food and Drug Administration)刚刚批准将其作为保护老年人免受 RS 病毒感染和防止新生儿在怀孕期间受到感染的疫苗。目前保护我们免受 SARS-CoV-2 感染的mRNA 疫苗也采用了类似的方法。这种疫苗利用融合前处于稳定状态的病毒尖峰蛋白来刺激免疫系统。
协助免疫系统
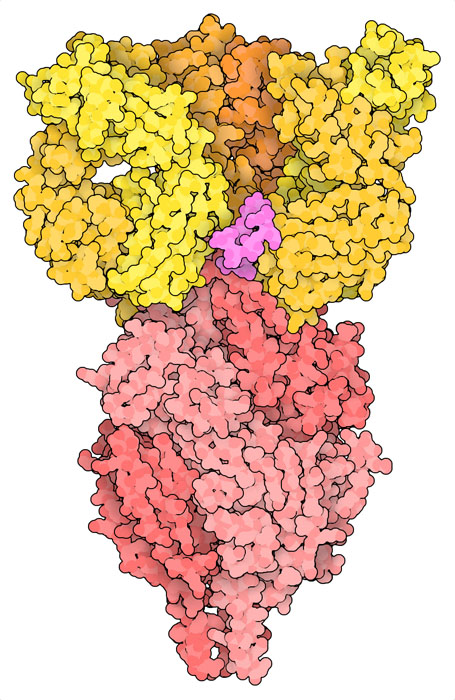
医学界正在使用补充方法来保护特别易感染的婴儿免受 RS 病毒感染。在这些情况下,注射抗RS病毒的抗体可提供抵御病毒的第一道屏障。这些抗体与疫苗诱导的抗体相似,能与融合前病毒表面的融合糖蛋白结合。PDB条目5udc的结构显示了抗体治疗nirsevimab(尼塞韦单抗)的作用原理。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
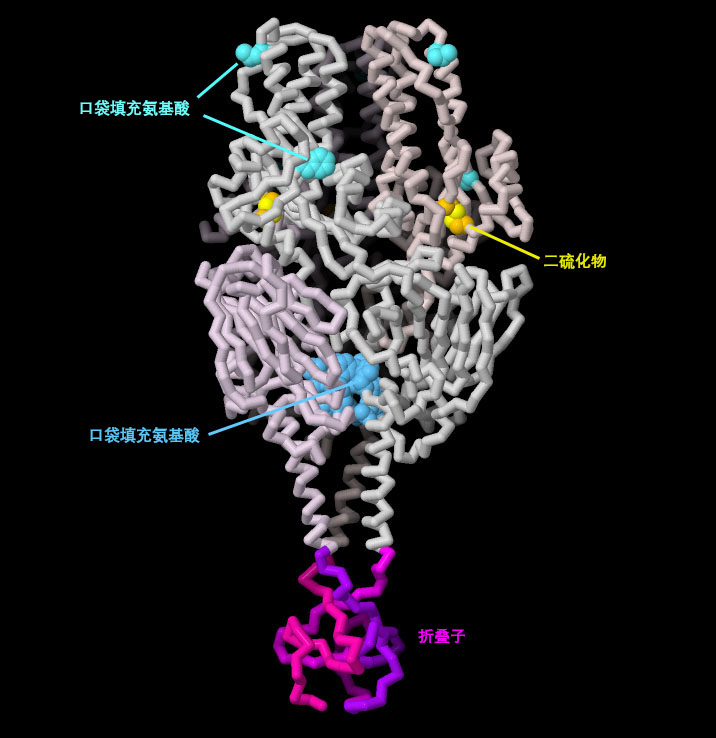
PDB 4mmv 的结构包含融合前处于稳定状态的 人類呼吸道合胞病毒 设计技术的原理验证研究。该蛋白质包含若干修饰以稳定蛋白质。在融合前状态下非常靠近的两个氨基酸之间增加了一个二硫键,但在融合后状态下,这两个氨基酸被置于蛋白质的两侧。一些氨基酸经过修饰,以填充小的空隙,从而进一步稳定了前融合型蛋白质。最后,一个短片段被添加到链的末端,形成一个"折叠子"(foldon),将三条链紧密结合在一起。点击图表下方的按钮,切换到交互式图片,查看该结构的更多细节。
进一步的讨论议题
- 有关 RS 病毒和抗 RS 病毒感染治疗方法的更多信息,请访问美国疾病控制中心。
参考文献
- 2021 RCSB Protein Data Bank resources for structure-facilitated design of mRNA vaccines for existing and emerging viral pathogens. Structure 29 1-14
- 5udc 2017 A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med 9 eaak1928
- 4mmv 2013 Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science 342 592-598
- 4jhw 2013 Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody. Science 340 1113-1117
- 3rrr 2011 Structure of respiratory syncytial virus fusion glycoprotein in the postfusion conformation reveals preservation of neutralizing epitopes. J Virol 85 7788-7796
 生物大分子学习的教育门户
生物大分子学习的教育门户 









