285: 組蛋白脫乙酰酶(Histone Deacetylases)
這篇文章和文章中的插圖是由Jessica Damanski,Paloma Munguia Salazar,Mihika Shah和Rajiv Snape撰寫和製作的,作為羅格斯定量生物醫學研究所(Rutgers Institute for Quantitative Biomedicine)組織的為期一周的本科生和研究生強化訓練營的一部分。這也作為2023-2024年PDB-101健康重點"癌症生物學和治療學"(health focus on "Cancer Biology and Therapeutics")的一部分發表。
人類基因組包含了全身細胞運作所需的大部分資訊。然而,不同類型的細胞所需的資訊往往不同。例如,神經細胞需要製造电压门控离子通道(voltage-gated ion channel),而肌肉細胞則需要製造大量的肌動蛋白(actin)、肌球蛋白(myosin)和肌聯蛋白(titin)。細胞透過選擇性地表達所需的基因來獲得其獨特的特性;對 DNA 訪問的部分控制是基於 DNA 與核小体中的组蛋白(histones in nucleosomes)包裹的緊密程度。組蛋白與 DNA 的親和力受帶電功能基團(如組蛋白末端的乙醯基)的添加或去除的調節,而這些功能基團決定了轉錄因子在何處結合以及哪些基因被表達。
去乙醯化監管者
組蛋白脫乙酰酶(histone deacetylase,HDAC)通常存在於細胞核中,催化從組蛋白末端去除乙醯基的反應。這些酶有兩個結構不同的家族。此處所示的組蛋白去乙醯化酶家族依賴鋅輔助因子,而長壽因子 (sirtuin)則使用NAD 輔助因子催化化學反應。這使得轉錄因子更難接觸到DNA,從而抑制了附近基因的表達。乙醯化和HDAC 也可用於調節許多其他蛋白質的功能,如p53腫瘤抑制基因 (p53 tumor suppressor) 和微管 (microtubule),甚至帶電分子,如聚醯胺。
瞄準HDAC
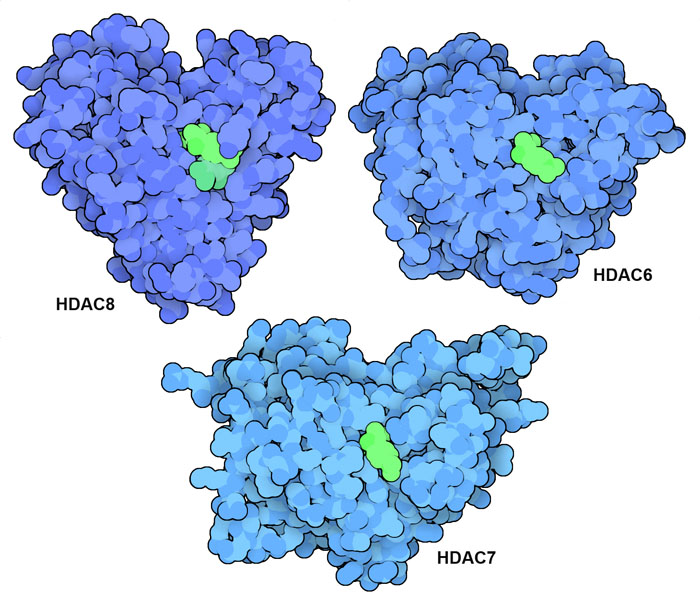
HDAC 透過影響致癌基因和抑癌基因的轉錄,參與多種癌症的產生和發展。高含量HDAC 通常與癌症患者的不良預後相關,因此HDAC 抑制劑成為抗腫瘤藥物的理想候選藥物。從細菌中提取的分子曲古抑菌素A(trichostatin A)是開發HDAC 抑制劑的起點。如HDAC8、HDAC7 和HDAC6(PDB ID 1t64、3c10 和5edu)的結構所示,這種藥物能與許多HDAC 活性位點結合。幾種抗癌藥物可改善曲古抑菌素A 的作用,目前已用於治療患者。
團隊合作
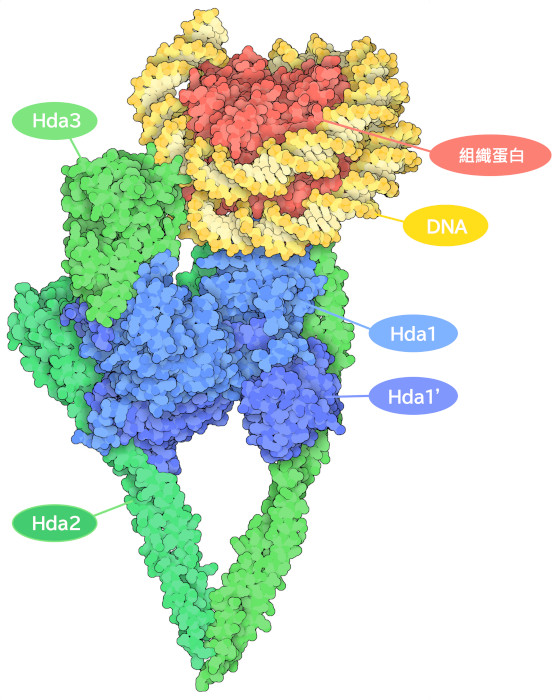
與許多參與基因調控的蛋白質一樣,HDAC 也不是單獨工作的。根據細胞類型和周圍環境的不同,它們是由多種蛋白質組成的複合體的一部分。此複合體中的蛋白質由轉錄因子調用,轉錄因子幫助HDAC 找到適當的調控位點。這些蛋白質發揮多種作用,包括調節HDAC 的活性、增強催化活性以及作為與其他酵素和蛋白質結合的橋樑。圖中所示的酵母細胞衍生複合物(PDB ID 6z6p)含有幾種與人類HDAC 酶類似的Hda 酶;Hda2 和Hda3 是非催化型,在Hda1-Hda1' 二聚體上形成一個V 形鉗夾。在此複合體中,Hda1 被激活,並位於從組蛋白末端移除乙醯基的位置。
探索結構
若要切換到有互動控制的頁面,請點擊圖表下方的按鈕。如果載入沒有開始,請嘗試點擊圖表。
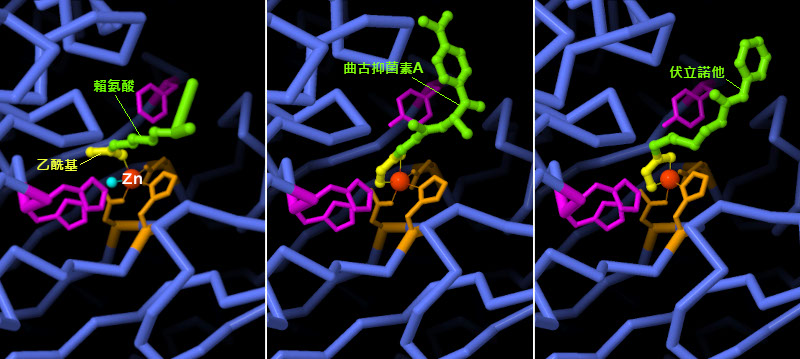
目前有多種HDAC 抑制劑被用作抗癌藥物。它們透過模擬氨基酸乙醯化賴氨酸(acetylated lysine)來發揮作用,該氨基酸是HDAC 的原始標靶;PDB ID 2v5w結構顯示了HDAC8 如何識別賴氨酸。鋅離子與乙醯基(黃色)配位,與其相鄰的一些胺基酸(紅紫色)和水分子(淺藍色)有助於去乙醯化反應,如曲古抑菌素A(PDB ID 1t64),一種從透明鏈黴菌( Streptomyces hygroscopicus )中分離出來的天然產物,也是美國FDA(美國食品藥物管理局)批准的抗癌藥物伏立諾他(Vorinostat,PDB ID 1t69),這種抑制劑具有模擬乙醯基和水的化學基團,可將分子牢固地固定在鋅離子上。點擊圖片下方的按鈕,切換到可操作的互動式圖片,詳細了解這些結構。
進一步的討論議題
參考文獻
- 1t64、1t69 2004 Structural snapshots of human HDAC8 provide insights into the Class I histone deacetylases. Structure 12 1325–1334
- 2v5w 2007 Substrate binding to histone deacetylases as revealed by crystal structure of Hdac8-substrate complex. EMBO Rep 8 879-884
- 3c10 2008 Crystal structure of catalytic domain of human histone deacetylase HDAC7 in complex with trichostatin A (TSA). J Biol Chem 283 11355-11363
- 5edu 2016 Crystal structure of human histone deacetylase 6 catalytic domain 2 in complex with trichostatin A. Nat Chem Biol 12 741-747
- 6z6p 2021 Structural basis for the regulation of nucleosome recognition and HDAC activity by histone deacetylase assemblies. Sci Adv 7 eabd4413
- 2012 Roles of histone deacetylases in epigenetic regulation: emerging paradigms from studies with inhibitors. Clin Epigenetics 4 5
- 2016 Histone and non-histone targets of dietary deacetylase inhibitors. Curr Top Med Chem 16 714-731
- 2016 HDACs and HDAC Inhibitors in cancer development and therapy. Cold Spring Harb Perspect Med 6 a026831
- 2017 Histone deacetylase 10 structure and molecular function as a polyamine deacetylase. Nat Comm 8 15368
- 2020 Histone deacetylases (HDACs): Evolution, specificity, role in transcriptional complexes, and pharmacological actionability. Genes (Basel) 11 556
- 2020 A short guide to histone deacetylases including recent progress on class II enzymes. Exp Mol Med 52 204–212
 生物大分子學習的教育門戶
生物大分子學習的教育門戶 









