286: RS 바이러스 융합 당단백질 (RSV Fusion Glycoprotein)
백신은 바이러스성 질환과 싸우는 의학계의 가장 강력한 도구 중 하나이며, 다음과 같은 구조로 기능하고 있다. 바이러스의 단편을 우리에게 투여함으로써 면역계를 자극하고 그 단편을 인식하는 항체를 만들게 하여 최종적으로 실제 바이러스가 공격해 왔을 때를 대비한다. 그러나 많은 경우 백신의 효과 여부는 어떤 바이러스 분자를 선택하느냐에 따라 결정적으로 좌우된다. 소아마비(polio) 백신이나 천연두(smallpox) 백신 같은 초기의 백신은 비활성화된 바이러스 전체나 위험성이 낮은 바이러스의 근연종을 사용하는 단순한 방식을 사용하였다. 현재는 보다 표적을 좁혀 바이러스의 가장 효과적인 부분만 골라 백신을 만드는 방법을 취하고 있다. 구조생물학은 이들 백신 분자가 효과를 최대한 발휘하도록 조정하는 데 도움을 주고 있다.
RS 바이러스 융합 당단백질
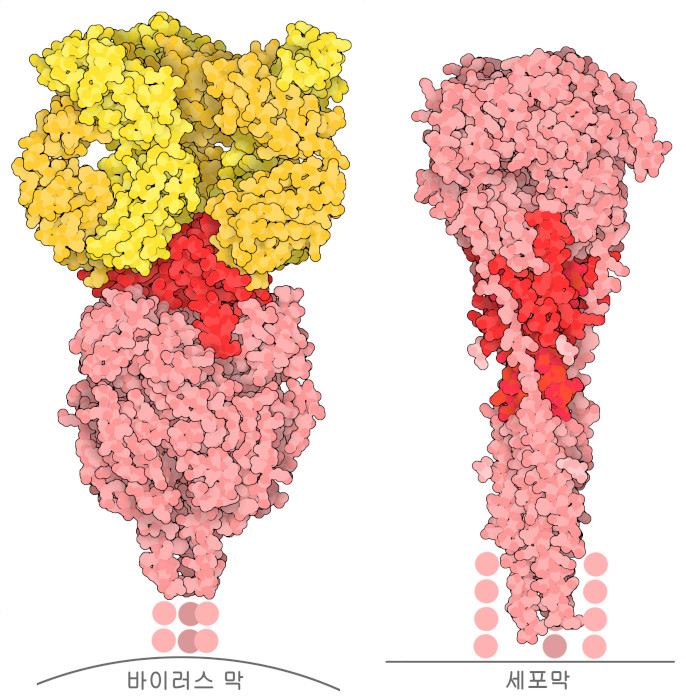
연구자들은 RS 바이러스(respiratory syncytial virus, RSV, 호흡기 합포체 바이러스)의 감염과 싸우는 백신 개발에 오랫동안 임해 왔다. RS 바이러스는 영유아나 노인의 생명을 위협하는 호흡기 감염병을 일으킨다. 이 백신 개발의 대부분은 바이러스의 융합 당단백질에 초점을 맞추어 이루어졌다. 이 당단백질은 바이러스 표면에 스파이크를 만들어 감염처가 되는 세포를 바이러스가 찾아내어 침입할 수 있도록 한다. 융합 당단백질은 항체가 접근하기 쉽고, 이를 저해함으로써 바이러스가 세포에 부착되는 것을 막을 수 있어 백신 표적으로는 매력적이다. 하지만 감염 과정에서 매우 큰 구조 변화를 일으키기 때문에 어려운 표적이기도 하다. PDB 엔트리 4jhw에서 볼 수 있듯이 바이러스 표면에 있는 ‘융합 전’의 형상은 컴팩트한 3량체이다. 위쪽에 있는 몇몇 루프(여기서는 진한 빨간색으로 나타냄)는 항체가 쉽게 접근할 수 있도록 되어 있어 주요 항원 부위를 구성하고 있다. 바이러스가 세포에 부착되면 3량체는 튕겨져 열려 세포막에 삽입된다. 이것이 바이러스와 세포의 가교 역할을 한다. 이후 단백질 전체의 대폭적인 배치 전환이 이루어져 최종적으로 PDB 엔트리 3rrr에서 볼 수 있는 ‘융합 후’의 형태가 된다. 이 구조를 보면 알 수 있듯이 모든 것이 다른 곳에 있고 주요 항원 부위는 단백질 한가운데 묻혀 있어 항체는 거의 접근할 수 없다.
백신 설계
RS 바이러스 백신 설계가 크게 진보한 것은 이들 구조를 개변하고 접착해 융합 전 형상을 갖도록 한 융합 당단백질이 설계되었을 때였다. 이 인공 설계 단백질은 감염성 바이러스에서 볼 수 있는 형상을 모방하고 있기 때문에 면역계를 자극해 바이러스에 집중하도록 촉진할 수 있다. 이 생각은 노인들을 RS 바이러스에 의한 감염으로부터 보호하고 임신 중 신생아가 감염되지 않도록 하기 위한 백신으로 미국식품의약국(US Food and Drug Administration)으로부터 막 승인을 받은 RS 바이러스 백신(알렉스비(Arexvy)와 아브리스보(Abrysvo))의 개발로 이어졌다. 현재 SARS-CoV-2 감염으로부터 우리를 보호하고 있는 mRNA 백신에도 비슷한 방법이 사용되고 있다. 이 백신은 융합되기 전 안정 상태에 있는 바이러스 스파이크 단백질을 사용해 면역계를 자극하는 것이다.
면역계를 돕다
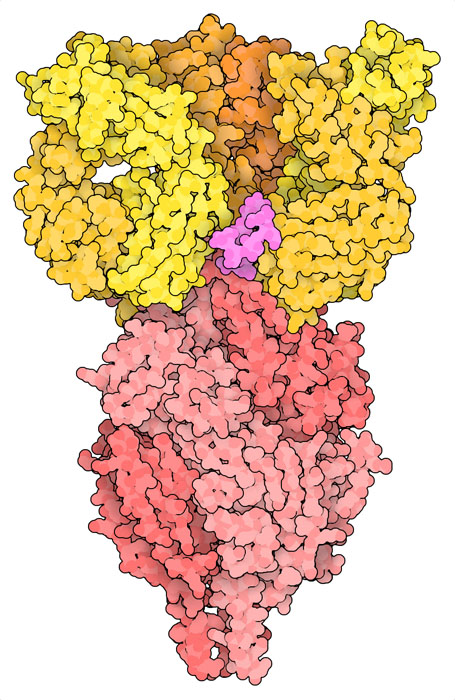
특히 감염되기 쉬운 유아의 경우 RS 바이러스 감염으로부터 보호하기 위해 더욱 보완적인 방법이 이용된다. 바이러스에 대한 제1선의 장벽이 되도록 항RS 바이러스 항체가 투여된다. 이들 항체는 백신에 의해 유발되는 항체와 비슷하며 바이러스 표면에 있어 융합 전 형상을 하고 있는 융합 당단백질에 결합한다. PDB 엔트리 5udc의 구조는 항체치료제 니르세비맙(nirsevimab)이 어떻게 작용하는지 나타낸다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
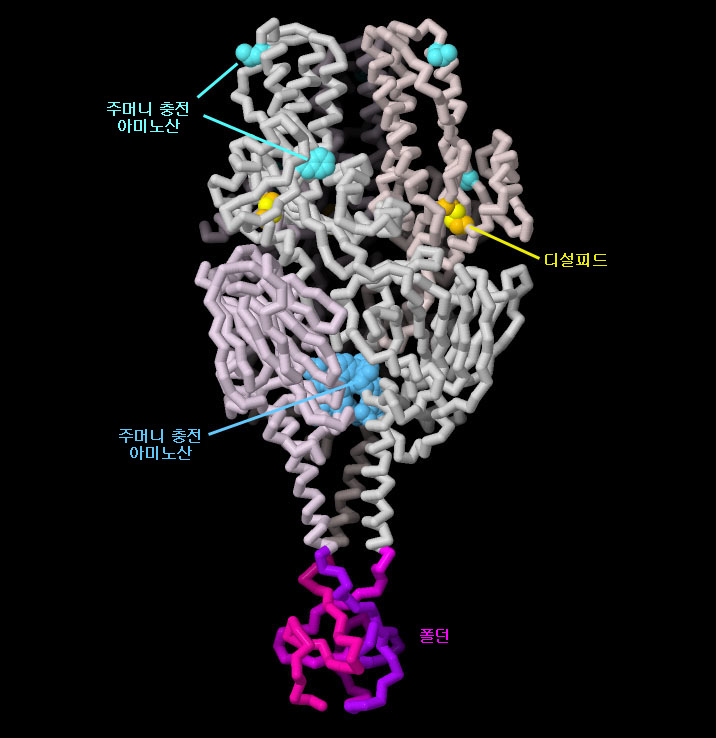
PDB 엔트리 4mmv 구조에는 융합 전 안정 상태에 있는 RS 바이러스 융합 당단백질의 설계 기술에 관한 원리 실증 연구가 포함되어 있다. 이 단백질에는 단백질을 안정화시키기 위한 몇 가지 변경 사항이 포함되어 있다. 융합 전의 형태에서는 매우 가까운 위치에 있으나 융합 후의 형태에서는 단백질 반대편에 배치되는 두 아미노산 사이에 디설피드 결합이 부가되어 있다. 몇몇 아미노산은 작은 주머니를 채우도록 수식되어 있으며, 이에 따라 융합 전의 형태는 더욱 안정화되어 있다. 마지막으로 사슬의 말단에 짧은 단편을 추가해 3개의 사슬을 견고하게 결합시키는 ‘폴돈’(foldon)을 만들고 있다. 그림 아래의 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환한 후 이 구조를 보다 자세히 살펴보기 바란다.
이해를 높이기 위한 토픽
- RS 바이러스 및 RS 바이러스 감염증 퇴치를 위한 치료법에 대해 미국질병관리센터 페이지(영어)를 참조하십시오.
참고문헌
- 2021 RCSB Protein Data Bank resources for structure-facilitated design of mRNA vaccines for existing and emerging viral pathogens. Structure 29 1-14
- 5udc 2017 A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med 9 eaak1928
- 4mmv 2013 Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science 342 592-598
- 4jhw 2013 Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody. Science 340 1113-1117
- 3rrr 2011 Structure of respiratory syncytial virus fusion glycoprotein in the postfusion conformation reveals preservation of neutralizing epitopes. J Virol 85 7788-7796
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









