285: 히스톤 탈아세틸화효소 (Histone Deacetylases)
이 기사는 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine)가 주최한 학부생 및 대학원생을 위한 1주일 집중 합숙의 일환으로 제시카 다만스키(Jessica Damanski), 팔로마 문기아 살라자르(Paloma Munguia Salazar), 미히카 샤(Mihika Shah), 라지브 스네이프(Rajiv Snape)에 의해 집필 및 제작된 것입니다. 또한 이 기사는 2023~2024년의 PDB-101 건강특집 ‘암에 관한 생물학과 치료법’(health focus on “Cancer Biology and Therapeutics”)의 일부로 발표된 것입니다.
인간 게놈에는 전신 세포가 기능하는 데 필요한 정보의 상당수가 포함되어 있다. 하지만 세포의 종류에 따라 필요한 정보는 다를 때가 많다. 예를 들어 신경세포는 전위의존성 이온채널(voltage-gated ion channel)을 만들어야 하고, 근육세포는 액틴(actin), 미오신(myosin), 티틴(titin)을 많이 만들어야 한다. 세포는 필요한 유전자를 선택적으로 발현시킴으로써 고유한 특성을 획득하고 있다. DNA에 대한 접근 제어의 일부는 DNA가 뉴클레오솜 안에 있는 히스톤(histones in nucleosomes)에 얼마나 심하게 감겨 있느냐에 따라 이루어진다. 히스톤의 DNA에 대한 친화성은 히스톤 말단에 있는 아세틸기같이 전하를 띤 관능기를 부가하거나 제거함으로써 조정되고, 전사인자가 어디에 결합하여 어떤 유전자 발현을 시작하는지를 결정하고 있다.
탈아세틸화 관리인
히스톤 탈아세틸화효소(histone deacetylase, HDAC)는 일반적으로 핵 내에 존재하며 히스톤 말단에서 아세틸기를 제거하는 반응을 촉매한다. 이 효소들에는 구조적으로 특징이 있는 2종류의 패밀리가 있다. 여기에 나타낸 히스톤 탈아세틸화 효소의 패밀리는 아연의 보효소에 의존하고 있지만 시르투인(sirtuin)은 NAD의 보효소를 사용해 화학반응을 촉매한다. HDAC에 의해 아세틸기가 제거되면 히스톤은 더욱 양으로 대전되고, 음으로 대전된 DNA를 더욱 강하게 감는다. 이에 따라 전사인자가 DNA에 더 접근하기 어려워져 근처에 있는 유전자의 발현이 억제된다. 아세틸화와 HDAC는 p53 종양억제인자(p53 tumor suppressor)나 미세소관(microtubule)과 같은 기타 많은 단백질, 심지어 폴리아미드와 같은 하전(荷電) 분자의 기능을 조절하기 위해서도 사용된다.
HDAC를 표적으로 하다
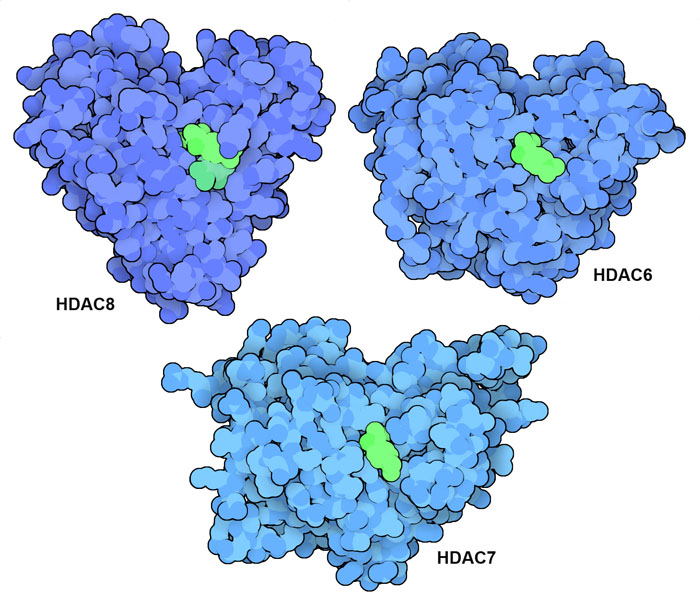
HDAC는 암 유전자와 암 억제 유전자의 전사에 영향을 줌으로써 몇 가지 유형의 암에서 발생과 진행에 관여하고 있다. 일반적으로 HDAC 농도가 높은 것과 암 환자의 예후 불량은 상관이 있기 때문에 HDAC 저해제는 항종양제의 매력적인 후보가 된다. 세균에서 유래한 트리코스타틴 A(trichostatin A)라는 분자는 HDAC 저해제 개발의 출발점이 되었다. 이 약제는 HDAC8, HDAC7, HDAC6의 구조(PDB ID 1t64, 3c10, 5edu)에 나타나 있듯이 많은 HDAC 활성 부위에 결합한다. 그리고 그 작용을 보다 개선한 항암제가 몇 가지 개발되어 현재 환자 치료에 사용되고 있다.
팀으로 일하다
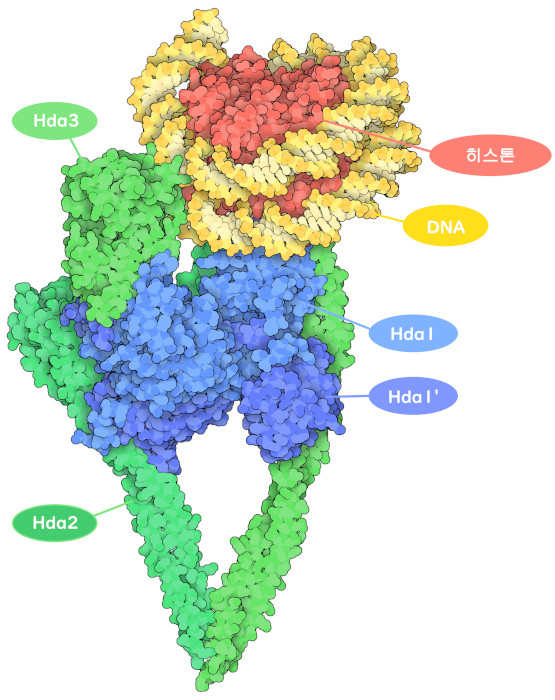
유전자 제어와 관련된 많은 단백질과 마찬가지로 HDAC도 단독으로 작용하지 않는다. 세포의 종류나 주위 환경에 따라 다양한 조성을 갖는 복수의 단백질로 구성된 복합체의 일부로 작용한다. 이 복합체 안에 있는 단백질은 전사인자에 의해 호출되어 HDAC가 적절한 제어 부위를 찾는 것을 돕는다. 이들 단백질은 HDAC 활성 조절, 촉매 활성 향상, 다른 효소 및 단백질과 결합하기 위한 가교 역할 등 다양한 역할을 담당하고 있다. 여기에 제시된 효모 세포에서 유래한 복합체(PDB ID 6z6p)에는 사람의 HDAC 효소와 비슷한 몇 가지의 Hda 효소가 포함되어 있다. Hda2와 Hda3는 비촉매성으로 Hda1-Hda1’ 2량체를 끼우는 V자형 클램프를 만들고 있다. 이 집합체에서 Hda1은 활성화되어 있으며 히스톤 말단으로부터 아세틸기를 제거하는 장소에 위치하고 있다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
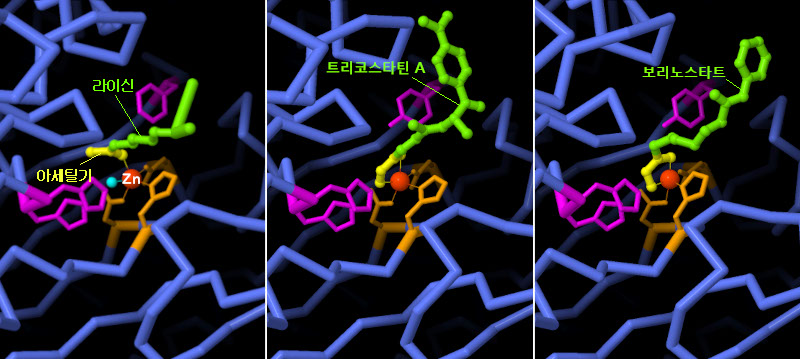
현재 다양한 HDAC 저해제가 항암제로 사용되고 있다. 이들은 HDAC가 원래 표적으로 삼고 있는 아미노산의 아세틸화 라이신(acetylated lysine)을 모방함으로써 작용한다. PDB ID 2v5w의 구조는 HDAC8이 어떻게 라이신을 인식하는지 나타내고 있다. 아연 이온은 아세틸기(노란색)에 배위하며 탈아세틸화 반응을 돕는 몇몇 아미노산(자홍색)이나 물 분자(하늘색)를 분자에 인접시킨다. Streptomyces hygroscopicus에서 분리된 천연물의 트리코스타틴 A(PDB ID 1t64)나 미국 FDA(미국식품의약국)가 승인한 항암제 보리노스타트(Vorinostat, PDB ID 1t69)의 구조에서 볼 수 있듯이 저해제에는 아세틸기와 물을 모두 모방하는 화학기가 있어 분자를 아연 이온에 단단히 고정하고 있다. 이미지 아래의 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환하여 이러한 구조를 보다 자세하게 조사해 보기 바란다.
이해를 높이기 위한 토픽
참고문헌
- 1t64、1t69 2004 Structural snapshots of human HDAC8 provide insights into the Class I histone deacetylases. Structure 12 1325–1334
- 2v5w 2007 Substrate binding to histone deacetylases as revealed by crystal structure of Hdac8-substrate complex. EMBO Rep 8 879-884
- 3c10 2008 Crystal structure of catalytic domain of human histone deacetylase HDAC7 in complex with trichostatin A (TSA). J Biol Chem 283 11355-11363
- 5edu 2016 Crystal structure of human histone deacetylase 6 catalytic domain 2 in complex with trichostatin A. Nat Chem Biol 12 741-747
- 6z6p 2021 Structural basis for the regulation of nucleosome recognition and HDAC activity by histone deacetylase assemblies. Sci Adv 7 eabd4413
- 2012 Roles of histone deacetylases in epigenetic regulation: emerging paradigms from studies with inhibitors. Clin Epigenetics 4 5
- 2016 Histone and non-histone targets of dietary deacetylase inhibitors. Curr Top Med Chem 16 714-731
- 2016 HDACs and HDAC Inhibitors in cancer development and therapy. Cold Spring Harb Perspect Med 6 a026831
- 2017 Histone deacetylase 10 structure and molecular function as a polyamine deacetylase. Nat Comm 8 15368
- 2020 Histone deacetylases (HDACs): Evolution, specificity, role in transcriptional complexes, and pharmacological actionability. Genes (Basel) 11 556
- 2020 A short guide to histone deacetylases including recent progress on class II enzymes. Exp Mol Med 52 204–212
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









