283: c-Abl蛋白激酶和伊马替尼(c-Abl Protein Kinase and Imatinib)
这篇文章和文章中的插图是由Allison Abel,Darlene R. Malave-Ramos,Bhavya Soni,AChristopher Thai和Amy Wu-Wu撰写和制作的,作为罗格斯定量生物医学研究所(Rutgers Institute for Quantitative Biomedicine)组织的为期一周的本科生和研究生强化训练营的一部分。这也作为2023-2024年PDB-101健康重点 "癌症生物学和治疗学 "(health focus on "Cancer Biology and Therapeutics")的一部分发表。
蛋白激酶(protein kinase)最初被避开作为癌症化疗的靶点。众所周知,蛋白激酶是绝佳的靶点,因为它们在细胞功能的各个方面都发挥着重要作用,并受到严格调控,任何调控的改变都可能导致癌症和其他疾病的发生。然而,细胞中有许多不同类型的激酶,它们在结构上相似,与ATP的结合位点也相似。长期以来,人们认为这些相似性将不可避免地导致脱靶结合,从而导致任何针对这些激酶活性位点的药物产生副作用。
结构打开大门
幸运的是,结构生物学证明这些最初的假设是错误的。随着蛋白激酶结构的阐明,人们发现它们的ATP结合口袋有足够的差异,从而有助于结构引导选择性药物的发现和开发。抗癌药物伊马替尼(imatinib)是一个具有里程碑意义的成功案例,自此之后,各种蛋白激酶的选择性小分子抑制剂被成功开发出来。其中许多都是结构引导药物发现的结果。
紊乱但不失调
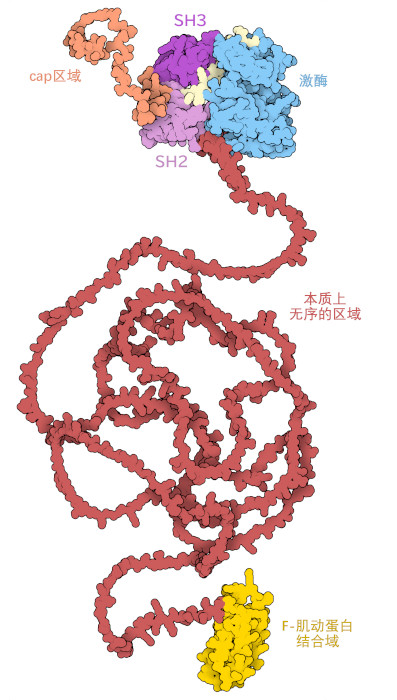
伊马替尼以c-Abl为靶点,c-Abl是一种酪氨酸激酶,可选择性地将磷酸基团从ATP转移至酪氨酸。从计算出的全长蛋白质模型(PDB条目AF_AFP00519F1)中可以看出,c-Abl是一个由多个功能部分组成的复合物。两个区域,激酶和调节结构域(kinase and regulatory domains,PDB条目1opl)和F-肌动蛋白结合结构域(F-actin binding domain,PDB条目1zzp),是稳定的折叠结构。使用X射线晶体学和核磁共振光谱进行详细研究表明,它们通过一个长的、固有的非恒定构象连接在一起,但保持高度柔性。一端是一个短的柔性尾部,称为帽区,与肉豆蔻酰基(myristoyl group)相连。帽区具有蛋白质的锁定机制,控制着蛋白质的功能。在非活性状态下,肉豆蔻酰基与激酶结构域中的一个口袋结合,导致构象变化,使激酶结构域与调节结构域紧密结合,阻止催化活性。为了激活蛋白,外部细胞信号与c-Abl的调控结构域相互作用,从激酶结构域释放肉豆蔻酰基,暴露出活性位点,使特定底物发生磷酸化。
癌变组合
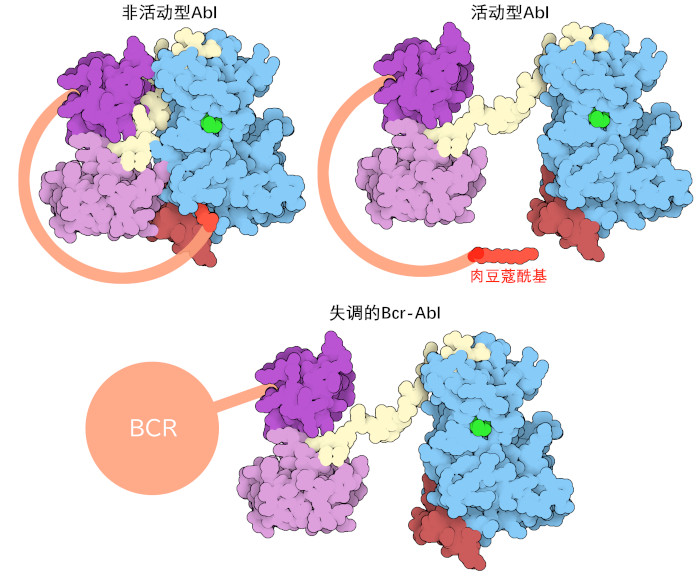
c-Abl酪氨酸激酶的基因异常与慢性骨髓性白血病(chronic myelogenous leukemia,CML)有关,这是一种骨髓中未成熟细胞的癌症。费城染色体(Philadelphia chromosome),当9号染色体的一部分被22号染色体的一部分取代时就形成了费城染色体。这种平衡的基因易位融合了c-abl和bcr基因,从而产生了一种名为Bcr-Abl的独立蛋白质。这种突变的酪氨酸激酶有一个自身抑制帽区,没有肉豆蔻酰基,因此它始终处于活性状态,不需要正常细胞信号的激活。这使得Bcr-Abl能够继续分裂;Bcr-Abl还能阻止细胞凋亡(apoptosis,细胞诱导自身死亡的过程),细胞通过凋亡来防止癌细胞的积累;Bcr-Abl的作用会导致不成熟的、部分功能的血液凋亡。由于Bcr-Abl的作用,未成熟的、部分功能的血细胞的积累会对被诊断为CML的患者产生破坏性影响,最终导致急性白血病(acute leukemic condition),称为急性转化期(blast phase,爆发期)。美国食品和药物管理局(United States Food and Drug Administration)批准的伊马替尼和其他Bcr-Abl抑制剂的治疗已将10年生存率大幅提高至约85%。许多CML患者现在的预期寿命与健康成人大致相同。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
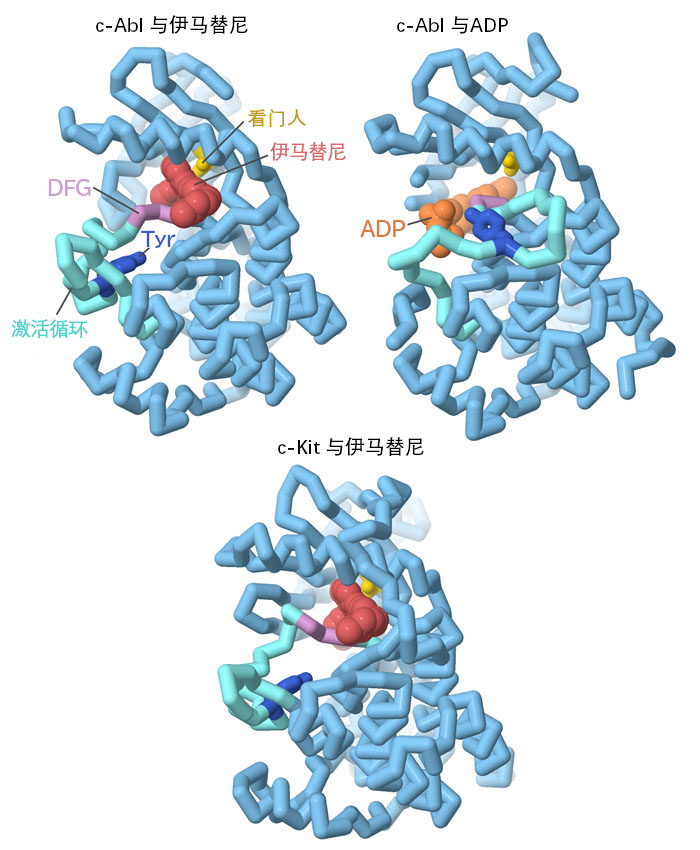
伊马替尼阻断c-Abl激酶结构域中的ATP结合位点并停止其作用,从激酶结构中可以看出,包括ADP(PDB条目2g2i)和伊马替尼(PDB条目2hyy),激酶中的几个区域对其功能和伊马替尼的抑制作用非常重要。"激活环"(activation loop)覆盖活性位点并控制活性位点的进入。它还受酪氨酸的调控,酪氨酸被磷酸化。"守门员"苏氨酸、"DFG基序"和几个氢键氨基酸(此处未显示)参与了与伊马替尼的特异性相互作用,有助于提高药物选择性。然而,伊马替尼并非完全具有选择性,但幸运的是,在某些情况下可以利用这一点。伊马替尼还可以抑制c-Kit(PDB条目1t46),这是一种导致胃肠道间质瘤(gastrointestinal stromal tumor,GIST)的癌症蛋白酪氨酸激酶。伊马替尼对这两种激酶都起作用。点击图表下方的按钮,切换到互动图片,更详细地了解这些结构。
进一步的讨论议题
References
- 2021 Kinase drug discovery 20 years after imatinib: progress and future directions. Nat Rev Drug Discovery 20 551–569
- 2020 Impact of the Protein Data Bank on antineoplastic approvals. Drug Discovery Today 25 837–850
- 2017 Structural and functional dissection of the DH and PH domains of oncogenic Bcr-Abl tyrosine kinase. Nat Commun 8 1–14
- 2013 Conformation-selective inhibitors reveal differences in the activation and phosphate-binding loops of the tyrosine kinases Abl and Src. ACS Chem Biol 8 2734–2743
- 2HYY 2006 Structural biology contributions to the discovery of drugs to treat chronic myelogenous leukaemia. Acta Cryst D Biol Crystallog 63 80–93
- 2G2I 2006 A src-like inactive conformation in the ABL tyrosine kinase domain. PLoS Biol 4 e144
- 2006 Organization of the SH3-SH2 unit in active and inactive forms of the c-Abl tyrosine kinase. Molecular Cell 21 787–798
- 1ZZP 2005 Structural basis for the cytoskeletal association of Bcr-Abl/c-Abl. Mol Cell 19 461–473
- 1XBB 2004 A novel mode of Gleevec binding is revealed by the structure of spleen tyrosine kinase. J Biol Chem 279 55827–55832
- 1T46 2004 Structural basis for the autoinhibition and STI-571 inhibition of c-kit tyrosine kinase. J Biol Chem 279 31655–31663
- 1OPL 2003 Structural basis for the autoinhibition of c-Abl tyrosine kinase. Cell 112 859–871
- 2002 Structure of the Bcr-Abl oncoprotein oligomerization domain. Nat Struct Biol 9 117–120
 生物大分子学习的教育门户
生物大分子学习的教育门户 









