283: c-Abl단백질 키나제 및 이마티닙 (c-Abl Protein Kinase and Imatinib)
이 기사는 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine)가 주최한 학부생 및 대학원생을 위한 1주일 집중 합숙의 일환으로 앨리슨 에이벨(Allison Abel), 다린 R 마라베-라모스(Darlene R. Malave-Ramos), 바브야 소니(Bhavya Soni), 크리스토퍼 타이(Christopher Thai), 에이미 우-우(Amy Wu-Wu) 가 집필 및 제작한 것입니다. 또한 이 기사는 2023~2024년의 PDB-101 건강특집 ‘암에 관한 생물학과 치료법’(health focus on “Cancer Biology and Therapeutics”)의 일부로 발표된 것입니다.
단백질 키나아제(protein kinase, 단백질 인산화효소)는 당초 암 화학요법의 표적으로는 기피되었다. 그것들은 세포 기능의 거의 모든 측면에서 중요한 역할을 하며 엄밀하게 제어되고 있으며, 그 제어에 어떠한 변화가 생기면 암이나 기타 질환의 발병으로 이어지기 때문에 우수한 표적이 된다고 이해되고 있었다. 하지만 세포 내에는 많은 종류의 키나아제가 존재하고, 이들은 모두 구조적으로 유사하며 ATP와의 결합 부위도 유사하다. 이러한 유사성 때문에 이들 키나아제의 활성 부위를 표적으로 하는 약제는 필연적으로 표적물 이외로의 결합을 일으킨 결과, 부작용이 생긴다고 오랫동안 생각되어 왔다.
문을 여는 구조
다행히 구조생물학은 이 같은 당초 추측이 오류임을 증명해 주었다. 단백질 키나아제의 구조가 규명됨에 따라 그 ATP 결합 주머니에는 충분한 차이가 있음을 알게 되어 구조 유도에 의한 선택적 약제의 발견과 개발이 용이해진 것이다. 항암제 이마티닙(imatinib)은 획기적인 성공 사례가 되었고, 이후 다양한 단백질 키나아제에 대한 선택적 저분자 저해제 개발에 성공했다. 그 대부분이 구조 유도 신약 개발의 성과에 의한 것이다.
구조는 정해지지 않지만 기능 부전은 아니다
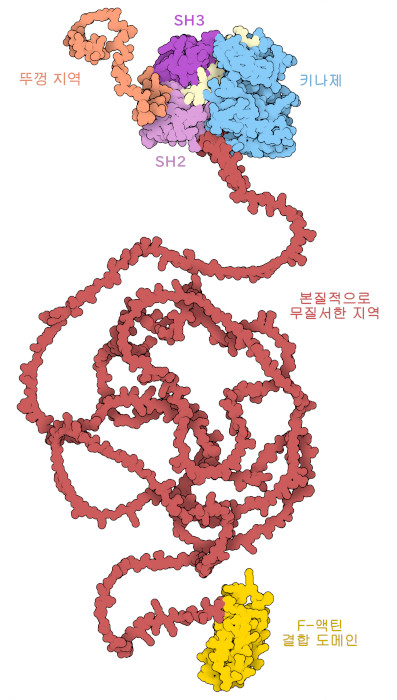
이마티닙이 표적으로 하는 c-Abl은 ATP로부터 티로신으로 선택적으로 인산기를 전이하는 티로신 키나아제이다. 계산에 의해 구한 단백질 전장의 모델(PDB 엔트리 AF_AFP00519F1)에서 볼 수 있듯이 c-Abl은 몇 가지 기능 부분을 가진 복합체이다. 키나아제 도메인 및 제어 도메인(kinase and regulatory domains, PDB 엔트리 1opl)과 F-액틴 결합 도메인(F-actin binding domain, PDB 엔트리 1zzp)이라는 2개의 영역은 안정된 접이식 구조를 가지고 있으며, X선 결정 구조 해석법과 NMR 분광법을 사용하여 상세하게 연구되어 있다. 이들은 길고 본래 일정한 구조를 취하지 않는 부분을 통해 연결되어 있으나 여전히 높은 유연성을 가지고 있다. 그리고 한쪽 끝에는 캡 영역이라 불리는 짧고 유연한 꼬리부가 있어 미리스토일 그룹(myristoyl group)와 결합되어 있다. 캡 영역은 단백질의 잠금 기구로서 작용하며 그 단백질의 기능을 제어한다. 불활성 상태에 있을 때는 이 미리스토일 그룹이 키나아제 도메인에 있는 주머니에 결합하고, 키나아제 도메인과 조절 도메인을 견고하게 결합시켜 촉매 활성을 저해하는 구조 변화를 일으킨다. 단백질을 활성화하려면 외부로부터의 세포 신호가 c-Abl의 제어 도메인과 상호 작용하여 키나아제 도메인에서 미리스토일 그룹이 유리하고 활성 부위를 노출시켜 특정 기질을 인산화할 수 있도록 한다.
암의 조합
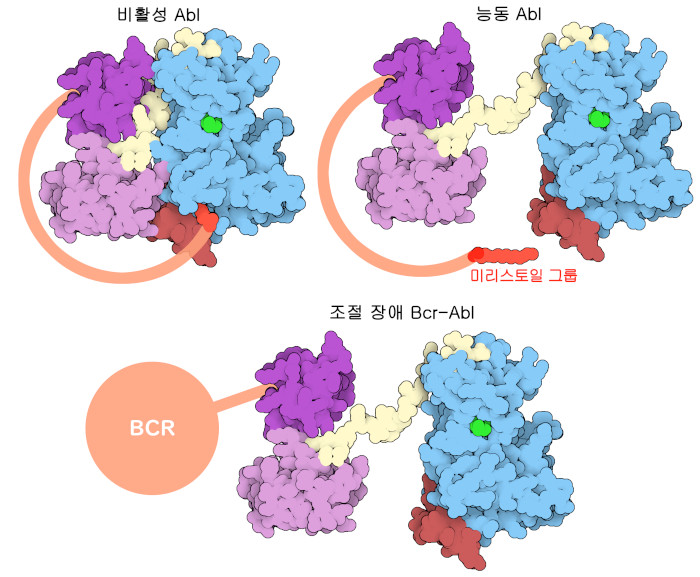
c-Abl 티로신 키나아제에 영향을 미치는 유전자 이상은 골수에 있는 미숙 세포의 암인 만성골수성백혈병(chronic myelogenous leukemia, CML)과 관련이 있다. CML의 원인은 필라델피아 염색체(Philadelphia chromosome)로 알려진 유전자 이상으로, 9번 염색체의 일부가 22번 염색체의 일부와 바뀌면서 형성된다. 이 균형 잡힌 유전자 전좌(轉座)에 의해 c-abl 유전자와 bcr 유전자가 융합되어 Bcr-Abl이라고 불리는 또 다른 단백질이 만들어진다. 이 변이형 티로신 키나아제는 자기억제성 캡 영역과 미리스토일 그룹을 갖지 않기 때문에 항상 활성이 있고, 일반적인 세포 신호에 의한 활성화를 필요로 하지 않는다. 이에 따라 Bcr-Abl은 세포분열을 계속할 수 있다. Bcr-Abl은 또한 암세포 축적을 막기 위해 세포가 수행하는 아포토시스(apoptosis, 스스로 죽음을 유도하는 세포에 갖추어진 과정)도 저지한다. Bcr-Abl의 작용에 의해 미성숙하고 부분적으로 기능하는 혈액 세포가 축적됨으로써 CML로 진단된 환자에게 괴멸적인 영향을 미쳐 최종적으로는 급성 전화기(blast phase)라고 불리는 급성백혈병 상태(acute leukemic condition)로 진행된다. 이마티닙과 미국식품의약국(United States Food and Drug Administration)이 승인한 기타 Bcr-Abl 저해제에 의한 치료로 10년 생존율은 약 85%로 극적으로 개선되었다. 현재 CML 환자의 상당수는 건강한 성인과 거의 같은 수명을 살 수 있게 되었다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
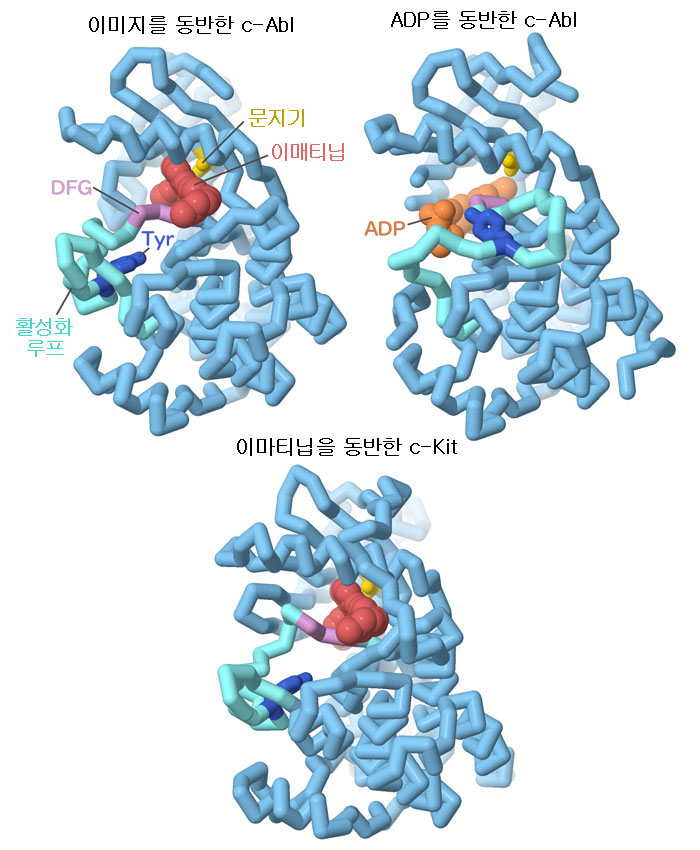
이마티닙은 c-Abl이 갖는 키나아제 도메인의 ATP 결합 부위를 막아 그 작용을 정지시킨다. ADP(PDB 엔트리 2g2i)와 이마티닙(PDB 엔트리 2hyy)을 포함한 키나아제의 구조에서 볼 수 있듯이 키나아제에 있는 몇 개의 영역이 그 기능과 이마티닙에 의한 저해에 있어서 중요하다. ‘활성화 루프’(activation loop)는 활성 부위를 덮쳐 뚜껑을 덮고 활성 부위로의 접근을 제어한다. 또한 인산화되는 티로신에 의해 제어된다. ‘문지기’인 트레오닌, ‘DFG 모티브’, 여기에 몇몇 수소결합아미노산(여기에 제시되지 않음)은 이마티닙과의 특이적 상호 작용에 관여해 약물 선택성을 높이는 데 도움을 주고 있다. 다만 이마티닙이 완전한 선택성을 갖고 있는 것은 아니지만 다행히도 이를 이용할 수 있는 경우가 있다. 이마티닙은 소화관간질종양(gastrointestinal stromal tumor, GIST)을 일으키는 암단백질 티로신 키나아제의 일종인 c-Kit(PDB 엔트리 1t46)도 저해한다. c-Kit과 c-Abl은 근연의 키나아제이며, 이마티닙은 양쪽에 효과가 있다. 그림 아래의 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환하여 이러한 구조를 더욱 자세하게 조사해 보기 바란다.
이해를 높이기 위한 토픽
- 키나아제 도메인과 제어 도메인을 자세히 보려면 RCSB PDB의 주석이 달린 시각화 사이트 3D Protein Structure View를 참조하십시오.
- 이마티닙은 조혈세포에서 면역 수용체의 신호전달에 관여하는 비장 티로신 키나아제(spleen tyrosine kinase, Syk)를 포함한 어느 일정한 배위의 키나아제에 대하여 효과를 나타냅니다. 이마티닙이 매우 콤팩트한 U자형 형상을 취하여 Syk를 저해하고 있음을 PDB 엔트리 1xbb의 구조에서 확인할 수 있습니다.
References
참고문헌
- 2021 Kinase drug discovery 20 years after imatinib: progress and future directions. Nat Rev Drug Discovery 20 551–569
- 2020 Impact of the Protein Data Bank on antineoplastic approvals. Drug Discovery Today 25 837–850
- 2017 Structural and functional dissection of the DH and PH domains of oncogenic Bcr-Abl tyrosine kinase. Nat Commun 8 1–14
- 2013 Conformation-selective inhibitors reveal differences in the activation and phosphate-binding loops of the tyrosine kinases Abl and Src. ACS Chem Biol 8 2734–2743
- 2HYY 2006 Structural biology contributions to the discovery of drugs to treat chronic myelogenous leukaemia. Acta Cryst D Biol Crystallog 63 80–93
- 2G2I 2006 A src-like inactive conformation in the ABL tyrosine kinase domain. PLoS Biol 4 e144
- 2006 Organization of the SH3-SH2 unit in active and inactive forms of the c-Abl tyrosine kinase. Molecular Cell 21 787–798
- 1ZZP 2005 Structural basis for the cytoskeletal association of Bcr-Abl/c-Abl. Mol Cell 19 461–473
- 1XBB 2004 A novel mode of Gleevec binding is revealed by the structure of spleen tyrosine kinase. J Biol Chem 279 55827–55832
- 1T46 2004 Structural basis for the autoinhibition and STI-571 inhibition of c-kit tyrosine kinase. J Biol Chem 279 31655–31663
- 1OPL 2003 Structural basis for the autoinhibition of c-Abl tyrosine kinase. Cell 112 859–871
- 2002 Structure of the Bcr-Abl oncoprotein oligomerization domain. Nat Struct Biol 9 117–120
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









