280: 主要组织相容性复合体I类肽加载复合物(MHC I Peptide Loading Complex)
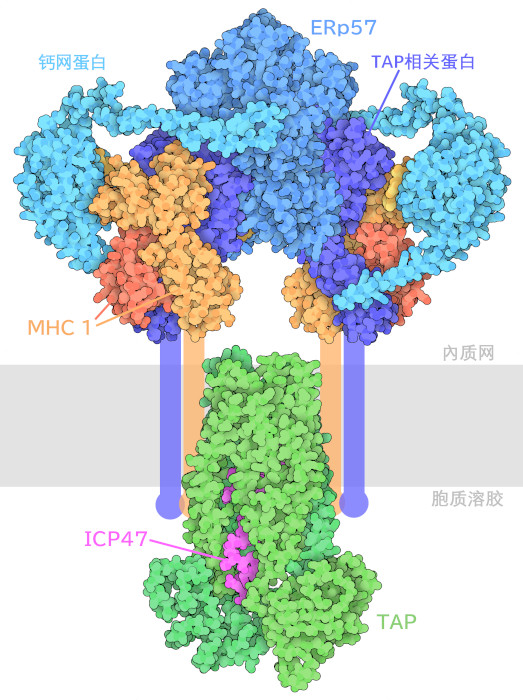
我们的免疫系统在不断地做出决定。它的任务是寻找并消灭感染和癌症,同时忽视健康生活所需的许多正常细胞过程。因此,当免疫系统发现一个受感染的细胞或肿瘤时,它需要确保真的有问题存在。如果做出错误的决定,健康细胞受到攻击,就会导致危及生命的炎症和自身免疫性疾病。主要组织相容性复合物 I(Major Histocompatibility Complex I,MHC I)帮助免疫系统做出这些决定。我们体内大多数的细胞都会切碎其内部蛋白质的一些副本,并使用MHC I在细胞表面呈现其小肽片段。这样一来,免疫系统就能监测到细胞内发生的情况。这里显示的肽装载复合物(peptide loading complex,PLC)帮助我们的细胞只识别最感兴趣的肽加载到MHCI。
加载复合物
肽装载复合物有许多功能,包括寻找空的MHC I,用肽链装载,检查肽-MHC I复合物稳定性,以及将复合物送到细胞表面。大部分的作用发生在内质网(endoplasmic reticulum)中。蛋白质伴侣钙网蛋白(calreticulin)通过识别MHC I表面的特征糖,并开始构建复合物。接下来,它会招募伴侣TAP相关蛋白(tapasin)、二硫异构酶ERp57和转运体TAP("与抗原加工有关的转运体",transporter associated with antigen processing)。一旦整体被组装好,肽就被吸收。最后,复合物被分解,葡萄糖(glucose)从MHCI糖链的末端被切断。这预示着肽-MHCI复合物已准备好进行运输。
行动中的PLC
这张图显示了由实验确定的肽装载复合物的两个不同部分的原子结构:PDB条目7qpd的结构显示了在内质网中发生的情况。钙网蛋白、TAP相关蛋白和ERp57围绕着MHC I。TAP相关蛋白改变了多肽结合凹槽的形状,使其一端稍宽,并在凹槽的一部分形成一个小盖子。这使得结合力弱的肽更难进入。PDB条目5u1d的结构包含TAPs,其任务是将肽运送到内质网。它与P-糖蛋白(P-glycoprotein)和其他多药转运体(multidrug transporter)类似,是一种ATP驱动的转运蛋白,由两个类似的蛋白亚基组成,形成穿过内质网膜的通道。在这种结构中,运输体被一种小型的单纯疱疹病毒蛋白ICP47冻结,它可以阻止病毒蛋白的转运并允许病毒躲避免疫系统。
双重检验
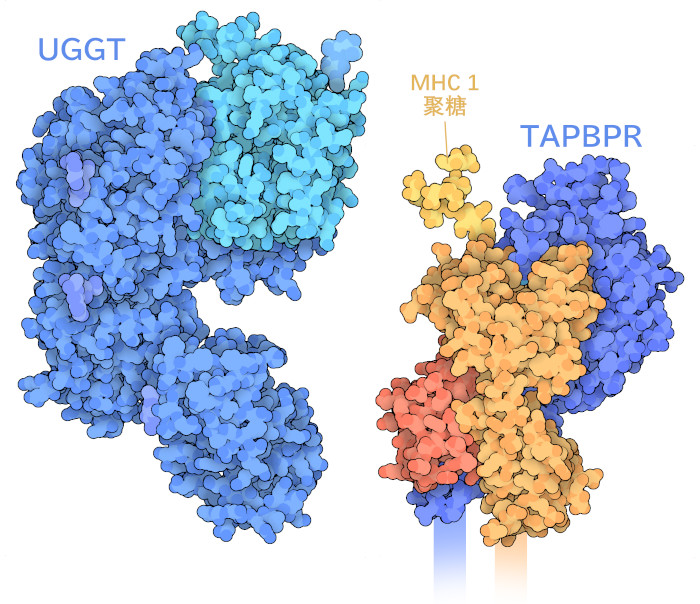 6cbp 的结构;在UGGT中,深蓝色显示的区域识别MHCI,而浅蓝色显示的区域进行糖基化反应。"/>
6cbp 的结构;在UGGT中,深蓝色显示的区域识别MHCI,而浅蓝色显示的区域进行糖基化反应。"/>
令人惊讶的是,第二级质量控制被用来确保只有最相关的肽才会显示在细胞表面上。当肽和 MHCI的复合物通过运输过程时,它会受到另一组蛋白质的检查。TAPBPR("TAP结合蛋白相关",TAP-binding protein-related,这里显示的是PDB条目5opi的结构)以类似于TAP相关蛋白的方式与MHC I结合,并检查肽是否紧密结合。如果肽没有通过检测,UGGT蛋白("UDP-葡萄糖:糖蛋白糖基转移酶",UDP-glucose:glycoprotein glucosyltransferase,这里显示的是PDB条目5mzo的结构)将会将葡萄糖添加回MHC聚糖链中,向细胞发出信号以回收空的MHC I到内质网进行另一次尝试。
修剪多肽
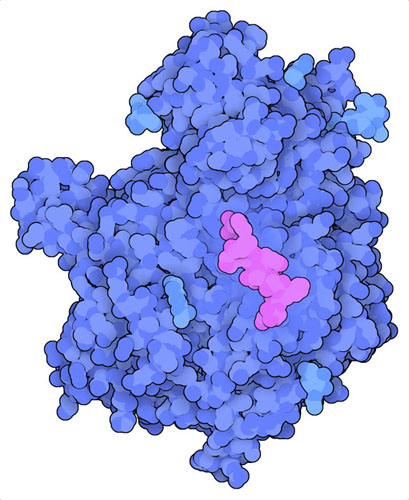
TAP转运蛋白向内质网输送多种肽,长度从8到40个氨基酸不等。然而,MHCI更喜欢8到10个氨基酸左右的短肽。因此,两种类似的酶,ERAP1和ERAP2("内质网氨基肽酶",endoplasmic reticulum aminopeptidase,这里显示的是PDB条目5ab0的结构),将肽的末端修剪到合适的大小。最近对人类DNA的历史研究揭示了这一过程是多么重要。中世纪爆发的黑死病(Black Death)是有史以来死亡率最高的疾病,导致三分之一到一半的人口死亡。最近对数百个当时人们的 DNA 提取物进行的一项研究表明,ERAP2活性较强的人有40%的生存机会。这是发生在有记录的历史时期中,人类进化自然选择的一个例子。在后来的腺鼠疫(bubonic plague)大流行的复发中,在几百年中一些人群显示出低死亡率。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
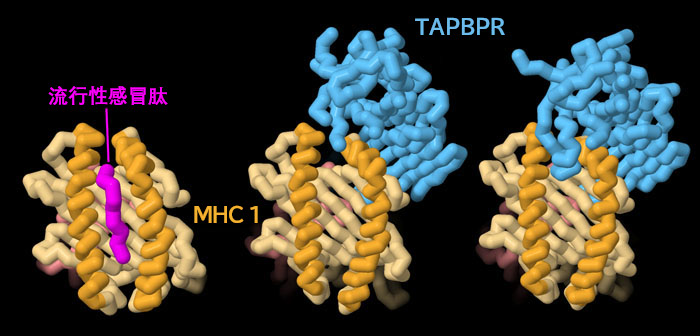
通过比较与肽结合的MHC I和与TAPBPR结合的MHC I的结构,我们可以看到TAPBPR如何校准复合物。在肽复合物中(PDB条目1hoc),MHC I中的两个α螺旋与肽的两侧紧密相邻,并在其整个长度上保持结合。另一方面,在TAPBPR复合物(PDB条目5wer)中,α螺旋稍微分开。最合适的肽需要有足够强的结合力,以诱导MHC转移到更紧、更窄的凹槽。点击图片下面的按钮,切换到交互式可操作的图片,可以看到这些结构的更多细节。
进一步的讨论议题
参考文献
- 7qpd 2022 Molecular basis of MHC I quality control in the peptide loading complex. Nat Commun 13 4701-4701
- 2022 Evolution of immune genes is associated with the Black Death. Nature 611 312-319
- 2020 Multifunctional chaperone and quality control complexes in adaptive immunity. Annu Rev Biophys 49 135-161
- 2019 MHC I chaperone complexes shaping immunity. Curr Op Immunol 58 9-15
- 2017 Structure of the human MHC-I peptide-loading complex. Nature 551 525-528
- 5mzo 2017 Interdomain conformational flexibility underpins the activity of UGGT, the eukaryotic glycoprotein secretion checkpoint. Proc Natl Acad Sci U S A 114 8544-8549
- 5opi 2017 Structure of the TAPBPR-MHC I complex defines the mechanism of peptide loading and editing. Science 358 1060-1064 DOI:10.1126/science.aao6001 PMID:29025996
- 5u1d 2016 Structure of the transporter associated with antigen processing trapped by herpes simplex virus. Elife 5 e21829
- 5ab0 2015 Structural basis for antigenic peptide recognition and processing by Endoplasmic Reticulum (ER) Aminopeptidase 2. J Biol Chem 290 26021-26032
- 1hoc 1994 The three-dimensional structure of H-2Db at 2.4 A resolution: implications for antigen-determinant selection Cell 76 39-50
 生物大分子学习的教育门户
生物大分子学习的教育门户 









