280: 주조직 적합성 복합체 클래스 I 펩티드 로딩 복합체 (MHC I Peptide Loading Complex)
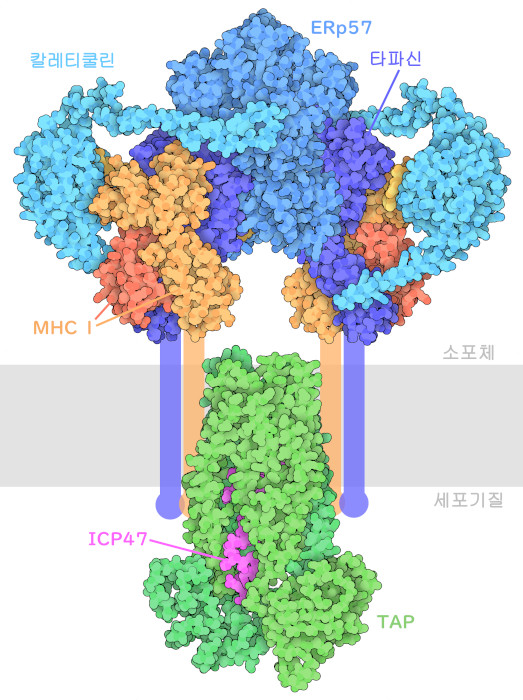
우리의 면역체계는 항상 의사 결정을 수행하고 있다. 감염병이나 암을 찾아내 파괴하는 동시에 건강한 생활에 필요한 많은 정상세포가 하는 과정은 무시하는 어려운 일을 강요받고 있다. 따라서 면역계가 감염된 세포나 종양을 발견했을 때는 정말 문제가 있는지 확실히 확인해 둘 필요가 있다. 만약 잘못된 결정을 내려 건강한 세포를 공격하면 생명을 위협하는 염증이나 자가면역질환으로 이어질 수 있다. 주조직 적합성 복합체 I(Major Histocompatibility Complex I, MHC I)은 면역계가 이러한 결정을 내리는 데 도움을 준다. 우리 세포 대부분은 세포 내에 있는 단백질을 몇 개 잘게 썰어 MHC I을 사용하여 그 작은 펩타이드 조각을 세포 표면에 제시한다. 이렇게 함으로써 면역계는 세포 내에서 무슨 일이 일어나는지 감시할 수 있다. 여기에 나타낸 펩타이드 로딩 복합체(peptide loading complex, PLC)는 세포가 가장 관심을 갖고 있는 펩타이드만을 MHC I에 인식시키는 데 도움이 된다.
복합체에 펩타이드 흡수
펩타이드 로딩 복합체에는 다양한 기능 부위가 있으며, 빈 MHC I을 찾아내는 부분, 펩타이드를 흡수시키는 부분, 펩타이드-MHC I 복합체의 안정성을 확인하는 부분, 그리고 복합체를 세포 표면으로 내보내는 부분으로 구성되어 있다. 그 작용의 대부분은 소포체(endoplasmic reticulum)에서 일어난다. 단백질 샤페론의 칼레티큘린(calreticulin)은 MHC I 표면에 있는 특징적인 당사슬(glycan)을 인식하여 복합체 구축을 시작한다. 다음으로 샤페론의 타파신(tapasin), 디설피드 이성화효소(disulfide isomerase)의 ERp57, 그리고 수송체의 TAP(‘항원 처리에 관한 수송체’, transporter associated with antigen processing)를 불러 모은다. 전체가 조립되면 펩타이드가 들어간다. 마지막으로 복합체가 분해되어 MHC I이 가진 당사슬 말단에서 포도당(glucose)이 잘라진다. 이것이 펩타이드-MHC I 복합체의 수송 준비가 되었다는 신호가 된다.
PLC가 활동하는 모습
이 그림에는 실험적으로 결정된 펩타이드 로딩 복합체의 서로 다른 두 부분에 관한 원자 구조를 나타내고 있다. PDB 엔트리 7qpd의 구조는 소포체 안에서 무슨 일이 일어나고 있는지를 나타내고 있다. 칼레티큘린, 타파신, 그리고 ERp57이 MHC I를 둘러싸고 있다. 타파신은 펩타이드가 결합하는 장소가 되는 홈의 형상을 변화시켜 한쪽 끝을 조금 넓게 하고, 또한 홈의 일부에 작은 뚜껑을 만든다. 이렇게 함으로써 결합력이 약한 펩타이드가 침투하기 어렵게 된다. 그 결과, 복합체는 펩타이드의 결합을 촉진하고 결합력이 강한 최적의 펩타이드를 우선시하게 된다. PDB 엔트리 5u1d의 구조에는 펩타이드를 소포체로 수송하는 역할을 담당하는 TAP가 포함되어 있다. 이는 P-당단백질(P-glycoprotein)이나 기타 다약제 수송체(multidrug transporter)와 마찬가지로 2개의 비슷한 단백질 서브유닛으로 구성된 ATP 구동형 수송체이고, 이들 서브유닛은 소포체막을 통과하는 통로를 만들고 있다. 이 구조에서 수송체는 단순 헤르페스 바이러스의 작은 단백질인 ICP47을 사용해 움직이지 않도록 하고 있다. ICP47은 바이러스 단백질 수송을 방해해 바이러스가 면역계에서 숨을 수 있도록 한다.
이중 체크
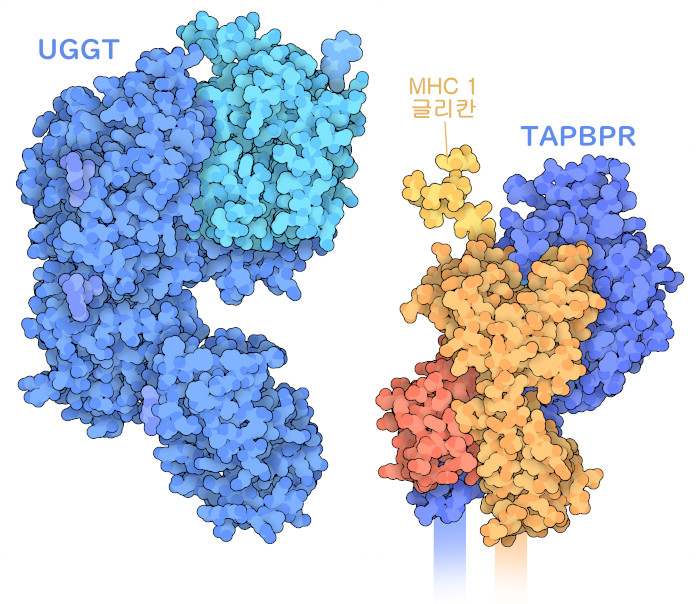
놀랍게도 가장 연관성이 높은 펩타이드만 세포 표면에 제시되도록 하기 위해 또 다시 한 단계의 구조를 사용하여 품질 관리가 이루어지고 있다. 펩타이드와 MHC I의 복합체가 수송 과정을 거쳐 이동하면 다른 단백질군에 의해 검사된다. TAPBPR(‘TAP 관련 결합 단백질’, TAP-binding protein-related, 여기에 나타낸 것은 PDB 엔트리 5opi의 구조)은 타파신과 같은 방법으로 MHC I에 결합하여 펩타이드가 제대로 결합되어 있는지 체크한다. 만약 펩타이드가 테스트에 합격하지 못하면 UGGT 단백질(‘UDP-글루코스: 당단백질 글리코실기 전이 효소’, UDP-glucose: glycoprotein glucosyltransferase, 여기에 나타낸 것은 PDB 엔트리 5mzo의 구조)이 MHC I의 당사슬에 포도당을 되돌려 놓는다. 이는 비워진 MHC I을 소포체로 되돌려 다른 일을 할 수 있도록 재활용하기 위한 세포에 대한 신호가 된다.
펩타이드 가장자리를 잘라 내다
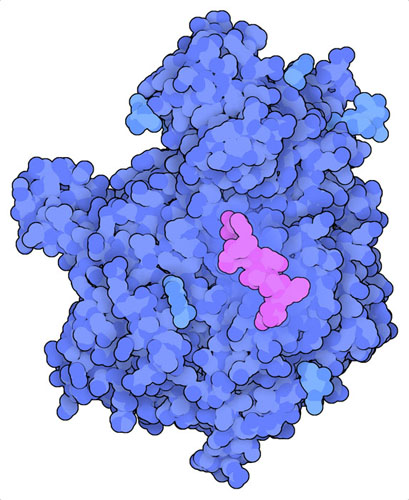
TAP 수송체는 길이가 8~40 아미노산 정도의 광범위한 펩타이드를 소포체로 전달한다. 하지만 MHC I은 8~10 아미노산 정도의 더 짧은 펩타이드를 선호한다. 따라서 비슷한 2개의 효소, ERAP1과 ERAP2(‘소포체 아미노펩티다아제’, endoplasmic reticulum aminopeptidase, 여기에 나타낸 것은 PDB 엔트리 5ab0의 구조)가 펩타이드의 가장자리를 잘라내어 적절한 사이즈로 만든다. 인간 DNA에 관한 최근의 역사적 연구에 의해 이 과정이 얼마나 중요한지가 밝혀졌다. 중세에 발생한 흑사병(Black Death)은 기록에 남는 역사상 가장 많은 사람이 사망한 사건으로 인류의 3분의 1에서 2분의 1이 사망한 것으로 알려져 있다. 당시 사람들로부터 추출된 수백 개의 DNA 추출물에 대한 최근 연구에 따르면 ERAP2 활성이 강해진 사람들은 생존 가능성이 40% 높아지는 것으로 나타났다. 이는 기록에 남는 역사의 시대에 발생한 인류의 진화적 자연 도태의 한 예이며, 나중에 가래톳 흑사병(bubonic plague) 팬데믹이 재발했을 때 어떤 집단은 수 세기 동안 낮은 사망률을 보였다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
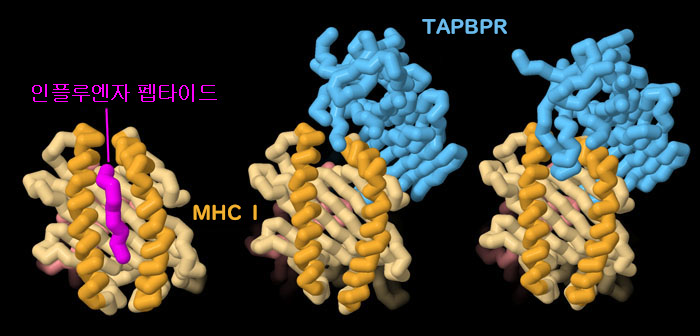
펩타이드에 결합한 MHC I과 TAPBPR에 결합한 MHC I의 구조를 비교함으로써 TAPBPR은 어떻게 복합체를 교정하고 있는지 확인할 수 있다. 펩타이드 복합체(PDB 엔트리 1hoc)에서는 MHC I 안에 있는 2개의 α 나선이 펩타이드 양쪽에 단단히 인접해 전체 길이에 걸쳐 펩타이드를 끌어안고 있다. 반면 TAPBPR 복합체(PDB 엔트리 5wer)에서는 α 나선이 조금 떨어져 있다. 가장 적합한 펩타이드는 MHC I을 보다 답답한 좁은 홈으로 변형시킬 수 있는 충분히 강력한 결합력이 필요하다. 이미지 아래의 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환하여 이러한 구조를 보다 자세하게 봐주기 바란다.
이해를 높이기 위한 토픽
- 여기에 나타낸 구조 중에는 일부 단백질의 막 관통 부분이 포함되어 있지 않습니다. 누락된 부분을 이해하려면 RCSB PDB 사이트에서 타파신 페이지 등 각 단백질의 Group Sequence 페이지를 참조하십시오.
- 세균 수송체에서 TAP와 비슷한 TmrAB가 가진 일련의 구조를 보면 수송에 필요한 다양한 배치를 확인할 수 있습니다. 예를 들어 안쪽 방향으로 열린 배치를 취하는 PDB 엔트리 6ran의 구조와 바깥 방향으로 열린 배치를 취하는 PDB 엔트리 6rah의 구조를 비교해 보십시오.
- 이달의 분자의 기사 T세포 수용체에 접속하여 이 펩타이드들이 어떻게 면역계에 인식되는지 확인해 보십시오.
참고문헌
- 7qpd 2022 Molecular basis of MHC I quality control in the peptide loading complex. Nat Commun 13 4701-4701
- 2022 Evolution of immune genes is associated with the Black Death. Nature 611 312-319
- 2020 Multifunctional chaperone and quality control complexes in adaptive immunity. Annu Rev Biophys 49 135-161
- 2019 MHC I chaperone complexes shaping immunity. Curr Op Immunol 58 9-15
- 2017 Structure of the human MHC-I peptide-loading complex. Nature 551 525-528
- 5mzo 2017 Interdomain conformational flexibility underpins the activity of UGGT, the eukaryotic glycoprotein secretion checkpoint. Proc Natl Acad Sci U S A 114 8544-8549
- 5opi 2017 Structure of the TAPBPR-MHC I complex defines the mechanism of peptide loading and editing. Science 358 1060-1064 DOI:10.1126/science.aao6001 PMID:29025996
- 5u1d 2016 Structure of the transporter associated with antigen processing trapped by herpes simplex virus. Elife 5 e21829
- 5ab0 2015 Structural basis for antigenic peptide recognition and processing by Endoplasmic Reticulum (ER) Aminopeptidase 2. J Biol Chem 290 26021-26032
- 1hoc 1994 The three-dimensional structure of H-2Db at 2.4 A resolution: implications for antigen-determinant selection Cell 76 39-50
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









