270: 丙酮酸激酶M2(Pyruvate Kinase M2)
本文由Faiza Ahmed,Jonathan Ash,Thirth Patel和Auriel Sanders撰寫和插圖,是羅格斯定量生物醫學研究所(Rutgers Institute for Quantitative Biomedicine)為本科生和研究生舉辦的為期一周的訓練營的一部分。該文章是2022-2023年PDB-101健康重點"癌症生物學和治療學"(Cancer Biology and Therapeutics)中的一篇。
癌細胞進行了許多根本性的改變以支持其不可控制的繁殖。值得注意的是,能量產生途徑的改編就是這樣的一種變化。在正常細胞中,將葡萄糖(glucose)轉化為能量的過程始於細胞膜中的糖酵解(glycolysis)。在糖酵解結束時產生的丙酮酸(pyruvate)通常進入線粒體進入檸檬酸循環(citric acid cycle)。在氧氣存在的情況下,該途徑通過電子傳遞鏈(electron transfer chain,複合物I、III、IV)和ATP合成酶(ATP synthase)的作用為有氧能量產生提供動力。癌細胞攝入了大量的葡萄糖,但自相矛盾地阻止了糖酵解的最後一步。這些細胞中產生的丙酮酸不會進入線粒體,而是轉化為乳酸。
丙酮酸激酶M2: 守門員
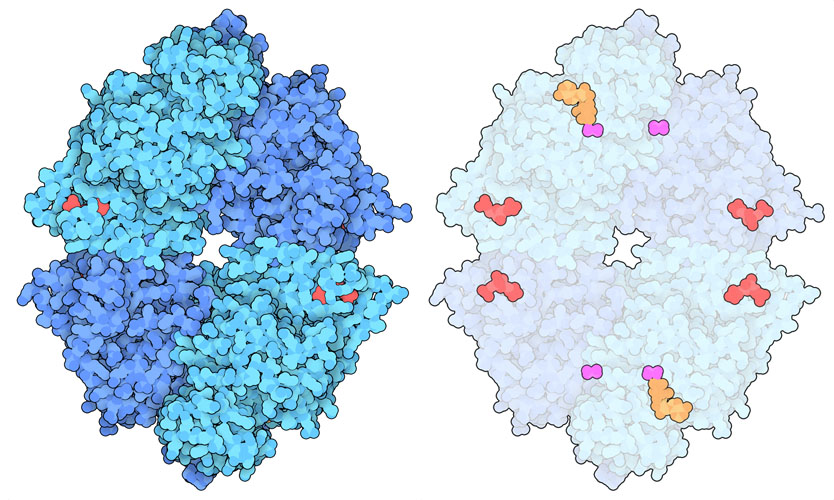
糖酵解的最後一步是由丙酮酸激酶(PDB ID4fxf)催化的。這種酶催化一個反應,從磷酸烯醇-丙酮酸轉移一個磷酸基,產生ATP(細胞的能量貨幣)和丙酮酸。丙酮酸激酶的活性受到嚴格的監管,因為它對細胞的存活至關重要。該酶會產生兩種聚合體,高活性的四聚體以及低活性的二聚體。當需要更多的能量時,雙磷酸果糖(雙磷酸果糖,在糖酵解系統中較早產生的分子)促進四聚體的形成。另一方面,其他各種調節分子可以與特定的異生位點(與活性位點分開但影響活性的位點)結合,促進二聚體的形成,抑制酶的活性。體內產生四種不同類型的組織特異性丙酮酸激酶。 PKM1產生於能量密集型細胞,PKR產生於紅細胞,PKL產生於肝細胞,PKM2通常產生於胚胎和其他生長細胞。 PKM1酶一般以四聚體形式存在,並始終具有活性。然而,一些異生調節分子與PKM2酶結合,通過影響該酶從四聚體到二聚體的轉變來控制其作用。癌細胞利用這種調節來重塑自己的代謝機制。
能源生產的悖論
許多癌細胞製造大量的酶丙酮酸激酶M2(pyruvate kinase M2,PKM2),將能量產生的途徑轉移到糖酵解系統。這種新陳代謝的重塑是自相矛盾的,原因有二。首先,即使在氧氣充足的情況下,這些細胞也不進行有氧能量生產。其次,這些快速分裂的細胞比正常細胞需要更多的能量,然而它們使用能量效率明顯較低的糖酵解作為其主要能量來源。這個悖論的解決方案在於減緩PKM2 造成的代謝瓶頸的另一個後果:它導致糖酵解中先前步驟的各種代謝中間體的積累。這些中間產物被轉移到一些生物合成途徑中,使癌細胞能夠製造快速生長所需的蛋白質和核酸構件。因此,癌細胞將生長置於能量生產之上。這種對葡萄糖利用的重新編程被稱為瓦爾堡效應。它是以發現它的研究人員奧托-海因里希-沃伯格命名的。
沃伯格效應和癌症治療
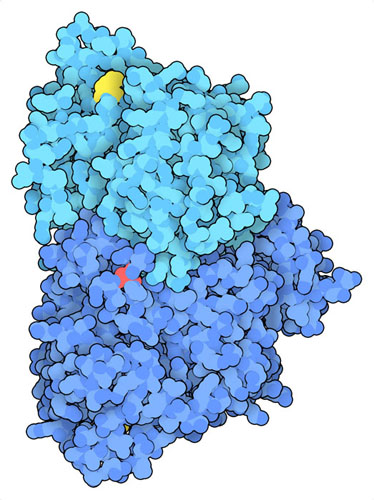
沃伯格效應是腫瘤發生的一個共同特徵。自發現以來,PKM2已被發現在癌細胞中被磷酸化和乙酰化(PDB條目6wp3 )。這些修飾影響了諸如2-磷酸果糖等激活劑結合的部位。沒有這些激活劑,PKM2不能有效地形成一個高活性的四聚體。這種酶的二聚體不僅在糖酵解中的活性較低,而且還可能轉入細胞核並促進其他致癌基因的轉錄。這些變化會導致乳酸的積累,促成腫瘤的形成和對癌症治療的抵抗。由於PKM2在癌細胞重編程中發揮著重要作用,目前正在研究尋找抑制PKM2的藥物和療法,或激活有氧代謝的替代方法。
探索結構
要切換到有互動控制的頁面,請點擊圖表下方的按鈕。如果加載沒有開始,請嘗試點擊圖表。
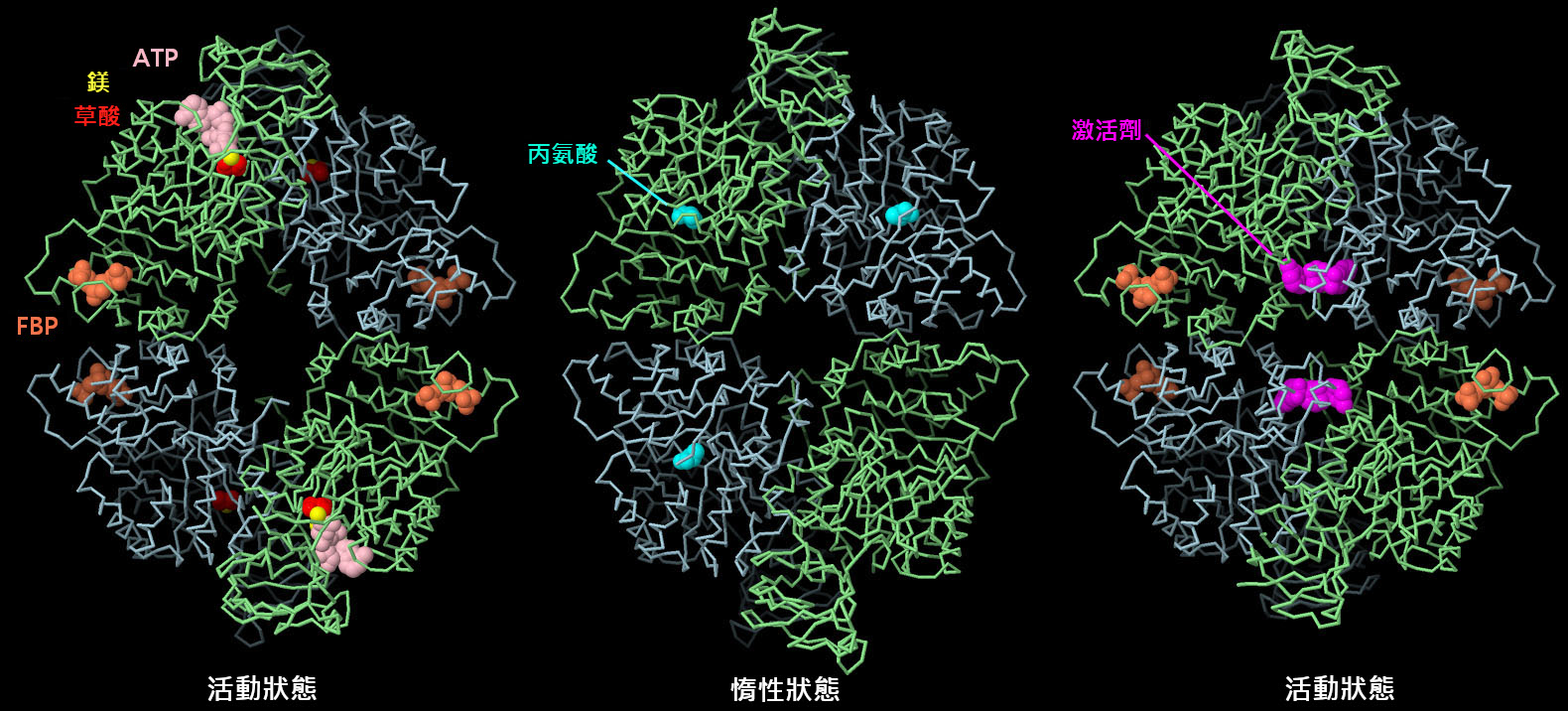
PKM2 四聚體的結構揭示了不同的小分子如何導致蛋白質的變構形狀變化,從而幫助調節其作用。上圖左側是活性結構(PDB ID4fxf),其活性位點含有ATP、草酸鹽(oxalate)和鎂(magnesium),調節位點有果糖二磷酸(FBP)。中間顯示的是非活性形式(PDB ID6gg3),控制位點為丙氨酸。注意形狀的變化和中間變窄的部位。目前研究人員正在積極研究尋找與PKM2結合的藥物分子以用於癌症治療。例如,在右圖所示的結構中(PDB ID3me3),一個人工激活劑分子(紅紫色)與FBP結合在一起,預計該分子會變為其活性形式,並有望逆轉用它處理的細胞中的Warburg 效應。
進一步的討論議題
- 抑制乳酸脫氫酶(lactate dehydrogenase)也可以減緩細胞生長,並用於監測癌症的進展和療效PDB條目4ajp,抗癌見乳酸脫氫酶與藥物的原型結合的結構。
- PDB存檔包含許多與各種小分子結合的人類PKM2結構;要找到它們,請轉到PDB條目4fxf,請訪問PDBj的PDB搜索(PDBj Mine)和在"外部數據庫"下,選擇"UniProt "並在輸入框中輸入"P14618 "以查看搜索結果。
參考文獻
- 2021 Revisiting the Warburg effect: Historical dogma versus current understanding. The Journal of Physiology 599 1745–1757
- 6wp3 2020 Structural basis for allosteric regulation of pyruvate kinase M2 by phosphorylation and acetylation. Journal of Biological Chemistry 295 17425–17440
- 2019 Pyruvate kinase M2: A simple molecule with complex functions. Free Radical Biology and Medicine 143 176–192
- 2019 Functional cross-talk between allosteric effects of activating and inhibiting ligands underlies PKM2 regulation. ELife 8 e45068 DOI:10.7554/eLife.45068
- 6gg3 2018 An allostatic mechanism for M2 pyruvate kinase as an amino-acid sensor. Biochemical Journal 475 1821-1837
- 2015 Pyruvate kinase: Function, regulation and role in cancer. Seminars in Cell & Developmental Biology 43 43–51
- 3me3 2012 Pyruvate kinase M2 activators promote tetramer formation and suppress tumorigenesis. Nature Chemical Biology 8 839-847
- 2009 Understanding the Warburg effect: The metabolic requirements of cell proliferation. Science 324 1029–1033
- 4fxf 2001 Five coplanar anion binding sites on one face of phospholipase A2: relationship to interface binding. Biochemistry 40 609-617
 生物大分子學習的教育門戶
生物大分子學習的教育門戶 









