270: 丙酮酸激酶M2(Pyruvate Kinase M2)
本文由Faiza Ahmed,Jonathan Ash,Thirth Patel和Auriel Sanders撰写和插图,是罗格斯定量生物医学研究所(Rutgers Institute for Quantitative Biomedicine)为本科生和研究生举办的为期一周的训练营的一部分。该文章是2022-2023年PDB-101健康重点 "癌症生物学和治疗学 "(Cancer Biology and Therapeutics)中的一篇。
癌细胞进行了许多根本性的改变以支持其不可控制的繁殖。值得注意的是,能量产生途径的改编就是这样的一种变化。在正常细胞中,将葡萄糖(glucose)转化为能量的过程始于细胞膜中的糖酵解(glycolysis)。在糖酵解结束时产生的丙酮酸(pyruvate)通常进入线粒体进入柠檬酸循环(citric acid cycle)。在氧气存在的情况下,该途径通过电子传递链(electron transfer chain,复合物I、III、IV)和ATP合成酶(ATP synthase)的作用为有氧能量产生提供动力。癌细胞摄入了大量的葡萄糖,但自相矛盾地阻止了糖酵解的最后一步。这些细胞中产生的丙酮酸不会进入线粒体,而是转化为乳酸。
丙酮酸激酶M2: 守门员
糖酵解的最后一步是由丙酮酸激酶(PDB ID4fxf)催化的。这种酶催化一个反应,从磷酸烯醇-丙酮酸转移一个磷酸基,产生ATP(细胞的能量货币)和丙酮酸。丙酮酸激酶的活性受到严格的监管,因为它对细胞的存活至关重要。该酶会产生两种聚合体,高活性的四聚体以及低活性的二聚体。当需要更多的能量时,双磷酸果糖(双磷酸果糖,在糖酵解系统中较早产生的分子)促进四聚体的形成。另一方面,其他各种调节分子可以与特定的异生位点(与活性位点分开但影响活性的位点)结合,促进二聚体的形成,抑制酶的活性。体内产生四种不同类型的组织特异性丙酮酸激酶。PKM1产生于能量密集型细胞,PKR产生于红细胞,PKL产生于肝细胞,PKM2通常产生于胚胎和其他生长细胞。PKM1酶一般以四聚体形式存在,并始终具有活性。然而,一些异生调节分子与PKM2酶结合,通过影响该酶从四聚体到二聚体的转变来控制其作用。癌细胞利用这种调节来重塑自己的代谢机制。
能源生产的悖论
许多癌细胞制造大量的酶丙酮酸激酶M2(pyruvate kinase M2,PKM2),将能量产生的途径转移到糖酵解系统。这种新陈代谢的重塑是自相矛盾的,原因有二。首先,即使在氧气充足的情况下,这些细胞也不进行有氧能量生产。其次,这些快速分裂的细胞比正常细胞需要更多的能量,然而它们使用能量效率明显较低的糖酵解作为其主要能量来源。这个悖论的解决方案在于减缓 PKM2 造成的代谢瓶颈的另一个后果:它导致糖酵解中先前步骤的各种代谢中间体的积累。这些中间产物被转移到一些生物合成途径中,使癌细胞能够制造快速生长所需的蛋白质和核酸构件。因此,癌细胞将生长置于能量生产之上。这种对葡萄糖利用的重新编程被称为瓦尔堡效应。它是以发现它的研究人员奥托-海因里希-沃伯格命名的。
沃伯格效应和癌症治疗
沃伯格效应是肿瘤发生的一个共同特征。自发现以来,PKM2已被发现在癌细胞中被磷酸化和乙酰化(PDB条目6wp3 )。这些修饰影响了诸如2-磷酸果糖等激活剂结合的部位。没有这些激活剂,PKM2不能有效地形成一个高活性的四聚体。这种酶的二聚体不仅在糖酵解中的活性较低,而且还可能转入细胞核并促进其他致癌基因的转录。这些变化会导致乳酸的积累,促成肿瘤的形成和对癌症治疗的抵抗。由于PKM2在癌细胞重编程中发挥着重要作用,目前正在研究寻找抑制PKM2的药物和疗法,或激活有氧代谢的替代方法。
探索结构
要切换到有互动控制的页面,请点击图表下方的按钮。如果加载没有开始,请尝试点击图表。
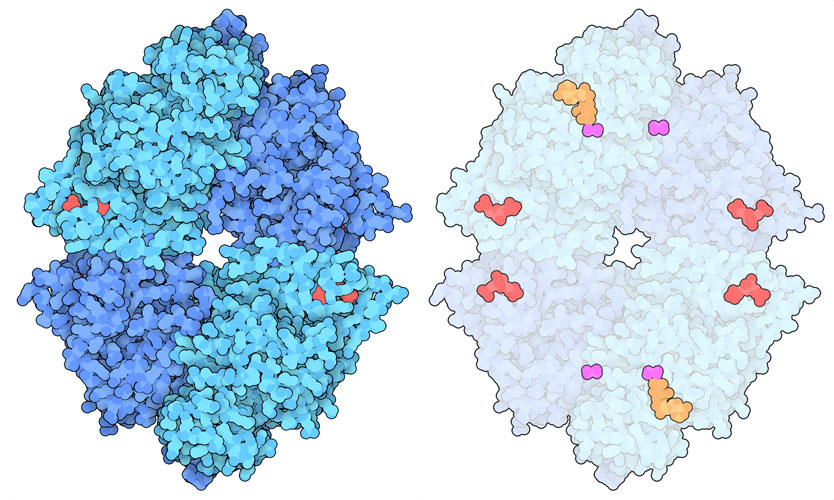
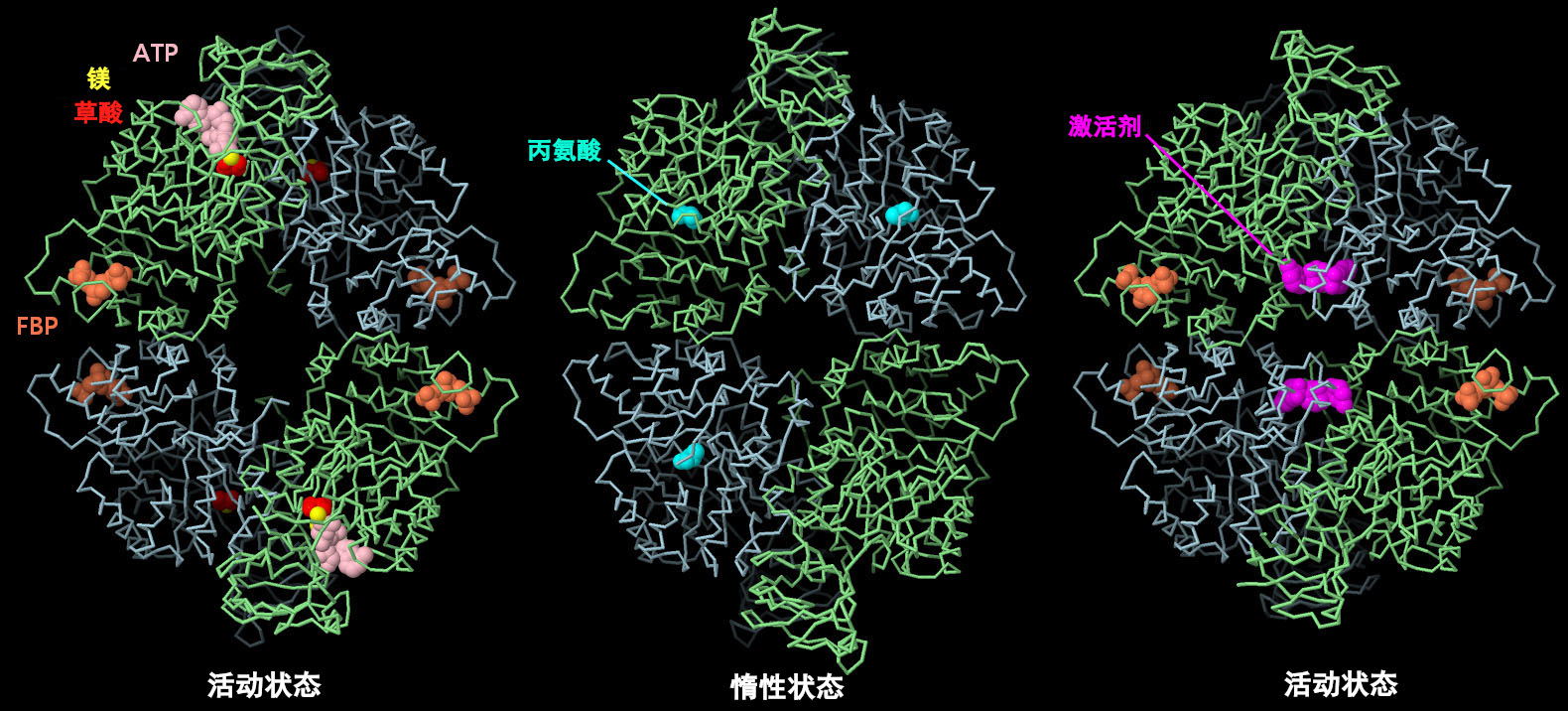
PKM2 四聚体的结构揭示了不同的小分子如何导致蛋白质的变构形状变化,从而帮助调节其作用。上图左侧是活性结构(PDB ID4fxf),其活性位点含有ATP、草酸盐(oxalate)和镁(magnesium),调节位点有果糖二磷酸(FBP)。中间显示的是非活性形式(PDB ID6gg3),控制位点为丙氨酸。注意形状的变化和中间变窄的部位。目前研究人员正在积极研究寻找与PKM2结合的药物分子以用于癌症治疗。例如,在右图所示的结构中(PDB ID3me3),一个人工激活剂分子(红紫色)与FBP结合在一起,预计该分子会变为其活性形式,并有望逆转用它处理的细胞中的 Warburg 效应。
进一步的讨论议题
- 抑制乳酸脱氢酶(lactate dehydrogenase)也可以减缓细胞生长,并用于监测癌症的进展和疗效 PDB条目4ajp,抗癌见乳酸脱氢酶与药物的原型结合的结构。
- PDB存档包含许多与各种小分子结合的人类PKM2结构;要找到它们,请转到PDB条目4fxf,请访问PDBj的PDB搜索(PDBj Mine)和在 "外部数据库"下,选择 "UniProt "并在输入框中输入 "P14618 "以查看搜索结果。
参考文献
- 2021 Revisiting the Warburg effect: Historical dogma versus current understanding. The Journal of Physiology 599 1745–1757
- 6wp3 2020 Structural basis for allosteric regulation of pyruvate kinase M2 by phosphorylation and acetylation. Journal of Biological Chemistry 295 17425–17440
- 2019 Pyruvate kinase M2: A simple molecule with complex functions. Free Radical Biology and Medicine 143 176–192
- 2019 Functional cross-talk between allosteric effects of activating and inhibiting ligands underlies PKM2 regulation. ELife 8 e45068 DOI:10.7554/eLife.45068
- 6gg3 2018 An allostatic mechanism for M2 pyruvate kinase as an amino-acid sensor. Biochemical Journal 475 1821-1837
- 2015 Pyruvate kinase: Function, regulation and role in cancer. Seminars in Cell & Developmental Biology 43 43–51
- 3me3 2012 Pyruvate kinase M2 activators promote tetramer formation and suppress tumorigenesis. Nature Chemical Biology 8 839-847
- 2009 Understanding the Warburg effect: The metabolic requirements of cell proliferation. Science 324 1029–1033
- 4fxf 2001 Five coplanar anion binding sites on one face of phospholipase A2: relationship to interface binding. Biochemistry 40 609-617
 生物大分子学习的教育门户
生物大分子学习的教育门户 









