268: HER2/neu和曲妥珠单抗(HER2/neu and Trastuzumab)
本文由Sol De Leon Cruz,Amber Herrod,Katherine H. Park和Amy Wu Wu撰写和插图,是罗格斯定量生物医学研究所(Rutgers Institute for Quantitative Biomedicine)为本科生和研究生举办的为期一周的训练营的一部分。该文章是2022-2023年PDB-101健康重点 "癌症生物学和治疗学 "(Cancer Biology and Therapeutics)中的一篇。
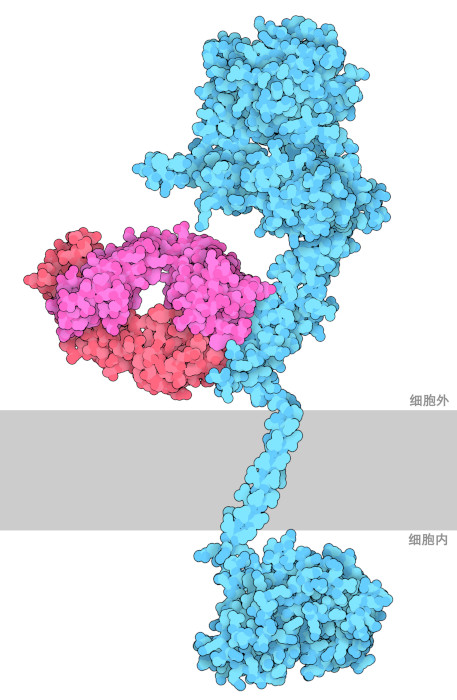
乳腺癌(breast cancer)是全球女性中因癌症死亡的首要病症。大约20%的浸润性乳腺癌含有过量的人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2),也被称为neu或ErbB2。当HER2基因过度复制时(HER2基因扩增,HER2 gene amplification)可能会发生这种现象,从而导致HER2受体的过度生产(HER2蛋白过度表达)。由于乳腺癌细胞的生长和分裂不受控制,使HER2过多的患者存活率下降,并且对化疗和激素治疗的效果较差。了解HER2的作用机制和三维结构有助于科研人员发现新的和有效的治疗方法来解决这些问题。
独特类型的出现
HER2是属于四种酪氨酸激酶受体(tyrosine kinase receptor,HER1,HER2,HER3和HER4)组成的家族的受体之一,这些受体蛋白被发现存在于在人体内许多细胞的细胞膜上。 这些受体蛋白通常调节重要的生物过程,如细胞生长,增殖,代谢,生存和分化。在系留形式下,蛋白质分子可以自行折叠,但不能与同一类型的受体或其他类型的受体结合。然而,开放,延伸性结构是通过与其配体相互作用形成的,并且可以自由形成复合物并参与信号传导。HER2在酪氨酸激酶中是独一无二的,因为它总是在不需要配体的情况下形成延展性的结构。这一特点使其成为理想的结合伙伴和肿瘤形成的主要贡献者。在正常的信号传导途径中,HER2经常与其他类型的HER受体形成复合体。然而,在癌细胞中,较高浓度的 HER2 除了与其他 HER 受体形成更多的正常复合物外,还会导致与其自身形成活性二聚体,从而向细胞发送更强的信号进行繁殖。
靶向HER2
阐明HER2的结构将有助于发现新的有效治疗乳腺癌的方法。实验室制造的单克隆抗体曲妥珠单抗(Trastuzumab)是一种获得 FDA(美国食品药品监督管理局)批准的 HER2 靶向治疗药物。曲妥珠单抗与HER2受体结合并抑制其同源二聚体化,可以抑制细胞增殖和复制,并最终减缓HER2阳性乳腺癌的生长。图中结构是由由三个PDB登录结构组成:具有曲妥珠单抗 Fab 部分的细胞外结构来自1n8z,细胞内的激酶结构来自3pp0,跨膜结构来自2ks1。不幸的是,尽管有这种临床益处,但抗体的整体影响是有限的,因为在使用曲妥珠单抗后通常会产生耐药性。
应对耐受性
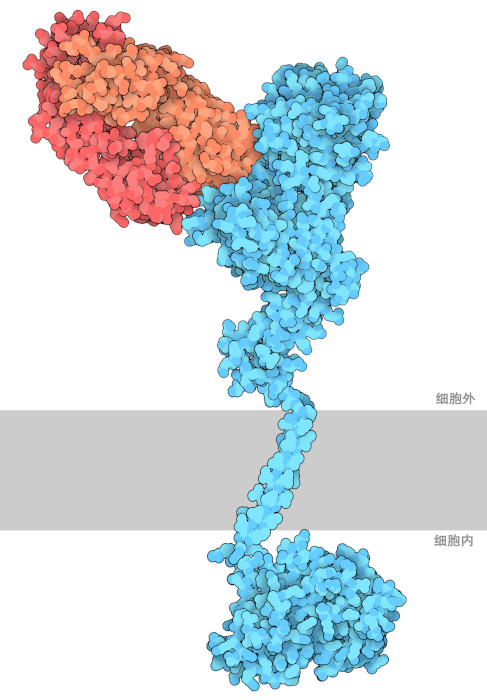
曲妥珠单抗极大地改善了HER2阳性乳腺癌患者的预后(对疾病过程的展望)。然而,大约50-60%的HER2阳性乳腺癌患者会对抗体产生耐药性,从而使其无效。为了解决这个问题,一种新的抗体帕妥珠单抗(Pertuzumab)已经问世,它同样针对HER2,但方式不同:正如在PDB1s78中看到的,这种抗体结合在远离细胞膜的HER2分子顶部,占据了HER2的结合位点,使得HER2无法与其他 HER 受体形成异构二聚体。帕妥珠单抗尤其能阻止 HER2:HER3 复合体的形成,后者在肿瘤形成中起到关键作用。 帕妥珠单抗也获得了 FDA 的批准,通过从源头阻断 HER2 信号级联,它有助于提高总体生存率和更好的反应,特别是在以前对治疗没有反应的患者中。帕妥珠单抗能特异性地抑制HER2:HER3复合物的形成,该复合物在致癌过程中起着重要作用。帕妥珠单抗也获得了 FDA 的批准,通过从源头阻断 HER2 信号级联,它有助于提高总体生存率和更好的治疗反应,特别是在以前对治疗没有反应的患者中。
探索结构
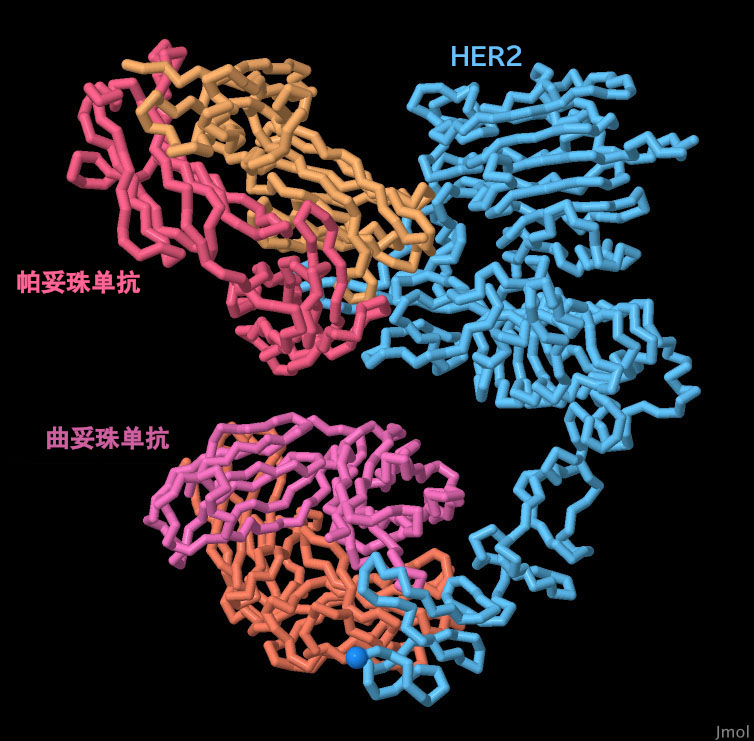
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
两种不同的治疗性抗体的可用性皆具有显著的优势。同时使用曲妥珠单抗和帕妥珠单抗,被称为双HER2抑制(Dual-HER2 inhibition),可以帮助克服曲妥珠单抗耐药性。这也可能有助于减少患者产生抗药性的可能性。当HER2在两个不同的位置受到攻击时(参考PDB6oge的结构),其更难产生突变并且同时对两种治疗法产生抗药性。 此外,该组合疗法有助于针对一些导致乳腺癌形成的HER2功能。曲妥珠单抗单独抑制同源二聚化,但保留了参与HER2异源二聚体的手臂功能。另一方面,帕妥珠单抗具有阻断异源二聚体的能力。这种联合治疗提供了抑制细胞增殖(曲妥珠单抗)和抑制HER2:HER3激活(帕妥珠单抗)的双重效益。事实证明,与单独治疗相比,双重抗 HER2 治疗已被证明可显著改善患者的预后治疗过程。要更详细地探索此结构,请单击图像以查看交互式 Jsmol。
进一步的讨论议题
参考文献
- 6oge 2019 Cryo-EM Structure of HER2-trastuzumab-pertuzumab complex. PLoS One. 14(5) e0216095
- 2018 Effect of VH-VL Families in Pertuzumab and Trastuzumab Recombinant Production, Her2 and FcγIIA Binding. Front Immunol. 9 469
- 2014 The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacol Res. 79 34-74
- 2012 Maximizing human epidermal growth factor receptor 2 inhibition: a new oncologic paradigm in the era of targeted therapy. J Clin Oncol. 30(14) 1712-1714
- 3pp0 2011 Structural analysis of the mechanism of inhibition and allosteric activation of the kinase domain of HER2 protein. J Biol Chem. 286(21) 18756-65
- 2011 Hallmarks of cancer: the next generation. Cell. 144(5) 646-674
- 2011 Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clin Cancer Res. 17(20) 6437-47
- 2ks1 2010 Spatial structure of the transmembrane domain heterodimer of ErbB1 and ErbB2 receptor tyrosine kinases. J Mol Biol. 400(2) 231-43
- 2007 Trastuzumab--mechanism of action and use in clinical practice. N Engl J Med. 357 39-51
- 1s78 2004 Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5(4) 317-28
- 1n8z 2003 Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab. Nature. 421(6924) 756-60
 生物大分子学习的教育门户
生物大分子学习的教育门户 









