268: HER2/neu와 트라스투주맙 (HER2/neu and Trastuzumab)
이 기사는 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine) 주최로 개최된 1주일간의 대학생 및 대학원생을 위한 집중 합숙의 일환으로서 솔 드 리온 크루즈(Sol De Leon Cruz), 엠버 헤로드(Amber Herrod), 캐서린 H. 박(Katherine H. Park), 에이미 우-우(Amy Wu Wu)에 의해 집필되고 그려진 것으로 2022-2023년 PDB-101의 건강 포커스 ‘암 생물학과 치료법’(Cancer Biology and Therapeutics)의 일부로도 게재되었습니다.
유방암(breast cancer)은 세계의 여성 사망 원인에서 암과 관련된 것 중에서는 1위를 차지하고 있다. 주위로 퍼지는 침윤성 유방암의 약 20%에는 인간 상피 성장인자 수용체 2(human epidermal growth factor receptor 2, HER2, neu 또는 ErbB2라고도 불림)가 과도하게 존재하고 있다. 이 상태는 HER2 유전자가 자신의 복제물을 너무 많이 만들어(HER2 유전자 증폭, HER2 gene amplification) HER2 수용체의 과잉 생산(HER2 단백질 과잉 발현)으로 이어지면 일어날 수 있다. HER2를 과다하게 가진 환자는 유방암 세포의 증식이나 분열을 제어할 수 없기 때문에 생존율이 떨어지고 화학요법이나 호르몬 요법에 대한 반응도 나빠진다. HER2의 작용기전과 입체구조를 이해하는 것은 이러한 문제에 대처하기 위한 새로운 효과적인 치료법을 발견하는 데 도움이 되고 있다.
독특한 유형의 대두
HER2는 4종류가 있는 티로신 키나아제 수용체(tyrosine kinase receptor, HER1, HER2, HER3, HER4)의 그룹(패밀리)에 속하는 수용체로, 신체 안에 있는 많은 세포에서 세포막에 매립되어 있다. 일반적으로 이들 수용체는 세포의 성장과 증식, 대사, 생존, 분화 등의 중요한 생물학적 과정을 제어하고 있다. HER 수용체가 취하는 구조는 테더형(tethered)과 신장형(extended) 등 2종류가 있다. 테더형의 경우 단백질은 접혀 있어 동종의 수용체나 다른 형태의 수용체와 결합할 수 없다. 한편 열린 신장형은 리간드와 상호 작용을 함으로써 형성되는 것으로, 자유롭게 복합체를 만들어 신호를 전달할 수 있다. HER2는 이런 종류의 티로신 키나아제 중에서는 독특하고, 리간드를 필요로 하지 않고 항상 신장형의 구조를 취한다. 이 특징은 결합 상대에게 이상적이며 종양 형성에 크게 기여하고 있다. 정상적인 신호 전달 경로의 경우 HER2는 다른 유형의 HER 수용체와 복합체를 형성하고 있는 경우가 많다. 그런데 암세포에서는 HER2의 농도가 높기 때문에 다른 HER수용체와의 사이에 형성되는 일반적인 복합체뿐만 아니라 HER2끼리 구성되는 활성형 2량체도 만들어져 세포에 대해 번식을 촉진하는 더 강한 신호가 보내지게 된다.
HER2를 표적으로 하다
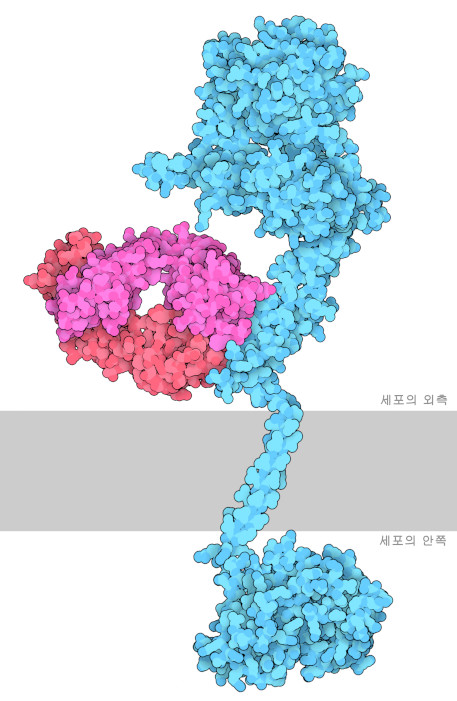
HER2의 구조를 규명하는 것은 유방암에 효과가 있는 새로운 치료법을 발견하는 데 도움이 된다. 실험실에서 만들어진 모노클로널 항체인 트라스투주맙(Trastuzumab)은 FDA(미국식품의약국)가 승인한 HER2를 표적으로 한 치료제다. 트라스투주맙은 HER2 수용체에 결합하여 호모 2량체화하는 것을 저해한다. 이를 통해 세포 증식이나 복제가 억제되어 결국 HER2 양성 유방암 증식을 늦출 수 있다. 여기에 나타낸 그림은 3개의 PDB 엔트리로 구성되어 있다. 트라스투주맙의 Fab 부분을 동반한 세포 외 도메인은 1n8z, 세포 내의 키나아제 도메인은 3pp0, 막 관통 도메인은 2ks1의 구조다. 그러나 안타깝게도 이러한 임상적 유용성이 있음에도 불구하고 투여 후 종종 내성을 획득하게 되어버리므로 트라스투주맙에 의한 전체적인 효과는 제한적이다.
내성에 대한 대처
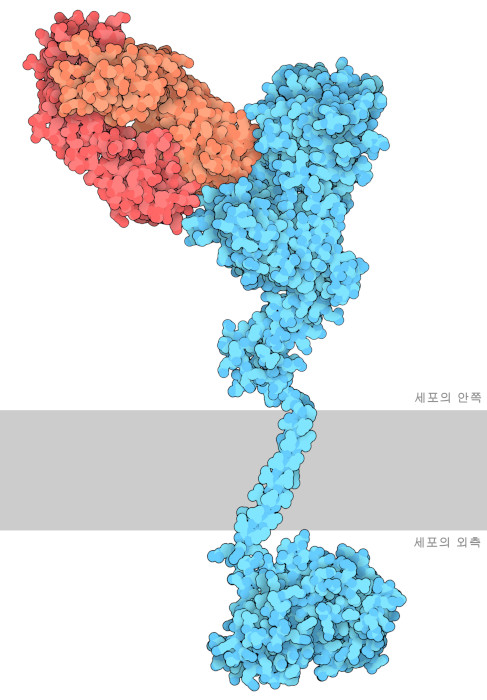
트라스투주맙으로 인해 HER2 양성 유방암 환자의 예후(병의 경과에 관한 전망)는 극적으로 개선되었다. 하지만 HER2 양성 유방암 환자의 약 50~60%가 내성이 생겨 항체가 듣지 않게 된다. 이 문제에 대처하기 위해 동일하게 HER2를 표적으로 하지만 방법은 다른 새로운 항체 퍼투주맙(Pertuzumab)이 도입되었다. PDB 엔트리 1s78에서 볼 수 있듯이 이 항체는 막에서 떨어진 분자 상부에 결합하여 HER2가 다른 HER 수용체와 헤테로 2량체를 형성할 때 사용하는 결합 포켓을 저해한다. 퍼투주맙은 특히 발암에서 중요한 역할을 하는 HER2:HER3 복합체의 형성을 저해한다. 퍼투주맙도 FDA의 승인을 받았으며, HER2 신호 전달에 관한 일련의 경로를 그 발생원에서 저해함으로써 특히 이전 치료에서는 효과가 높지 않았던 환자에서 전체 생존율을 높이고 더 나은 효과를 거두는데 도움을 주고 있다.
구조 보기
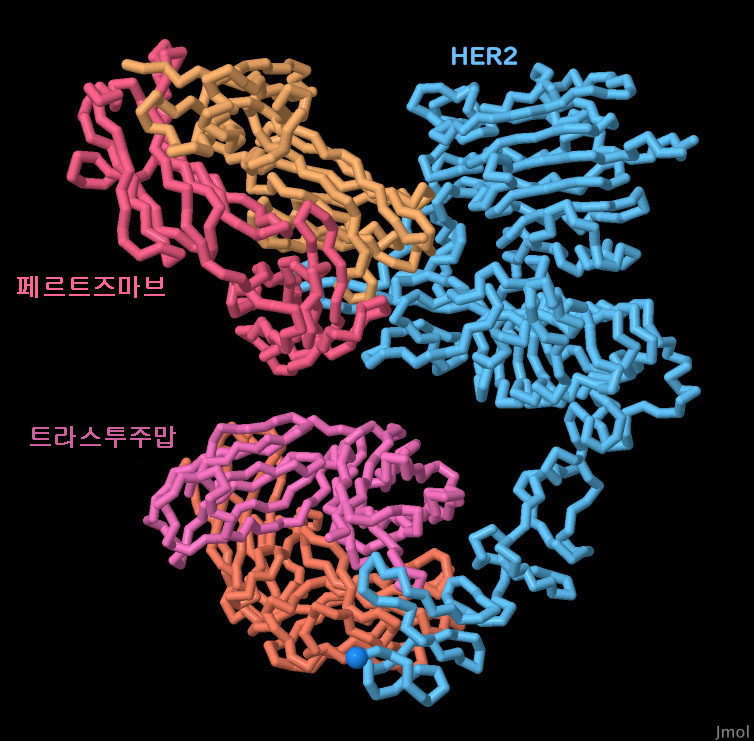
대화적 조작을 할 수 있는 페이지로 전환하려면 그림아래의 버튼을 클릭해 주세요.읽기가 시작되지 않을 때는 그림을 클릭해 보세요.
2종류의 치료용 항체를 이용할 수 있는 데는 큰 이점이 있다. 트라스투주맙과 퍼투주맙을 동시에 사용하는 방법은 듀얼 HER2 저해(Dual-HER2 inhibition)로 알려져 있는데, 이 치료법을 사용함으로써 트라스투주맙 내성을 극복할 수 있다. 또한 환자가 내성을 갖는 것을 억제하는 데도 도움이 될 수 있다. 여기에 나타낸 PDB 엔트리 6oge의 구조에서 알 수 있듯이 HER2가 2개의 다른 장소에서 공격을 받으면 단백질을 변이시켜 양쪽 치료제 모두에 동시에 내성을 갖는 것은 더욱 어려워진다. 게다가 이 병용 요법은 유방암 진행에 기여하는 HER2의 기능을 여러 개 표적으로 삼는 데도 도움이 되고 있다. 트라스투주맙 단독으로는 호모 2량체화를 저해하지만 HER2 헤테로 2량체화에 관련된 능력은 기능한 채로 있다. 한면 퍼투주맙은 헤테로 2량체화를 저해하는 능력을 갖고 있다. 이 병용 요법에 의해 세포 증식 저지(트라스투주맙)와 HER2:HER3의 활성화 저지(퍼투주맙)라는 양쪽 모두의 혜택을 입을 수 있다. 항HER2제의 이중 투여는 단독 투여에 비해 환자의 치료 경과를 현저히 개선하는 것으로 나타났다. 이미지 아래의 버튼을 클릭하여 인터랙티브로 조작할 수 있는 이미지로 전환하여 이 구조에 대해 보다 자세하게 살펴 보기 바란다.
이해를 높이기 위한 토픽
참고문헌
- 6oge 2019 Cryo-EM Structure of HER2-trastuzumab-pertuzumab complex. PLoS One. 14(5) e0216095
- 2018 Effect of VH-VL Families in Pertuzumab and Trastuzumab Recombinant Production, Her2 and FcγIIA Binding. Front Immunol. 9 469
- 2014 The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacol Res. 79 34-74
- 2012 Maximizing human epidermal growth factor receptor 2 inhibition: a new oncologic paradigm in the era of targeted therapy. J Clin Oncol. 30(14) 1712-1714
- 3pp0 2011 Structural analysis of the mechanism of inhibition and allosteric activation of the kinase domain of HER2 protein. J Biol Chem. 286(21) 18756-65
- 2011 Hallmarks of cancer: the next generation. Cell. 144(5) 646-674
- 2011 Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clin Cancer Res. 17(20) 6437-47
- 2ks1 2010 Spatial structure of the transmembrane domain heterodimer of ErbB1 and ErbB2 receptor tyrosine kinases. J Mol Biol. 400(2) 231-43
- 2007 Trastuzumab--mechanism of action and use in clinical practice. N Engl J Med. 357 39-51
- 1s78 2004 Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5(4) 317-28
- 1n8z 2003 Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab. Nature. 421(6924) 756-60
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









