245: スプライソソーム(Spliceosomes)
生物学においてこれほど単純なものはない! 遺伝情報の流れに関する基本的なしくみは細菌において発見されたもので、それはまずDNAから伝令RNA(messanger RNA、mRNA)へと転写(transcript)されて次にそれがタンパク質へと翻訳(translate)されることを示していた。しかし、より複雑な生物で調べようとしたとき、話は複雑になった。私たちのDNAにコードされている遺伝子は通常、タンパク質に翻訳される伝令RNA鎖よりも4倍から10倍長い。わたしたちのゲノムをより詳しくみると、ほとんどの遺伝子のタンパク質のコード部分はエクソン(exon)と呼ばれる区間に分かれていて、それらはイントロン(intron)と呼ばれる長い非コード配列で隔てられている。イントロンの数はタンパク質によって幅があり、例えば私たちのヘモグロビン(hemoglobin)遺伝子は3つに、巨大なタイチン(titin)の場合は365個の区間に分割されている。分割して遺伝子を持っていると、細胞はいろいろな方法で遺伝子のスプライシング(つなぎ合わせ)ができるという大きな利点がある。同じDNA配列を使って少しずつ機能が違うさまざまなタンパク質を生み出すことができるのだ。
スプライシング反応
スプライソソーム(spliceosome)は遺伝子からつくられた長い伝令RNA前駆体分子を切ってつなぎ直し、タンパク質をつくるのに使われるより短い伝令RNA分子をつくり出す。これは多くの部品からできた複雑な分子機械で、タンパク質鎖といくつかの小さなRNA鎖が含まれている。複合体は段階的な方法でつくられていて、スプライシングの各反応段階ごとにサブユニットの付加や除去が行われる。まず、つなぎ合わせる2つの部位が認識され近くに集められる。次に、一方のスプライス部位が切断され、末端がイントロン内にある特別なアデニンヌクレオチドにつながれてループ構造ができる。最後に、もう一方のスプライス部位が切断されてイントロンループが放出され、エクソンの末端同士がつながれる。
動的な構造
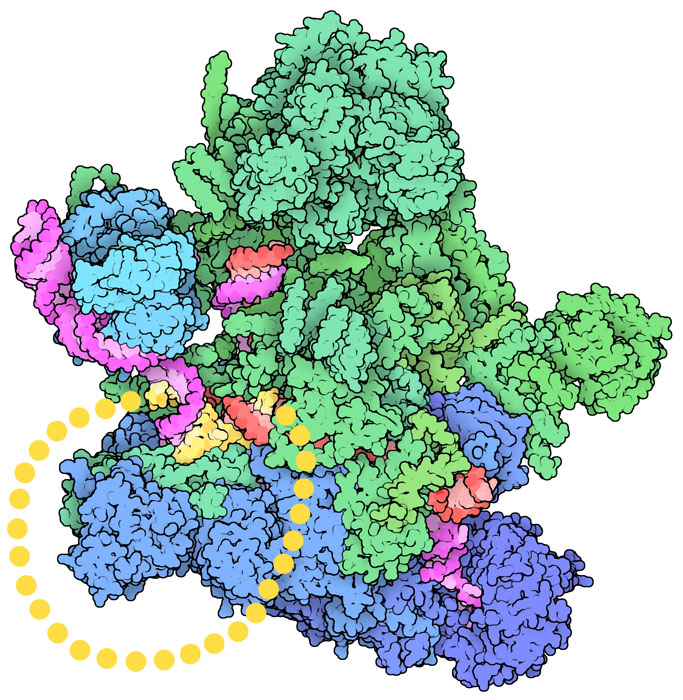
スプライソソームが行う反応のさまざまな段階を調べるのにクライオ電子顕微鏡(cryoelectron microscopy)が使われている。スプライソソームは非常に動的な機械なので、複合体の安定な部分しか構造は明らかになっていない。そのため今見ていただいているように、動的で観察できない部分の構造は想像で補う必要がある。ここに示す構造はPDBエントリー3jb9から得られたもので、スプライシングの最終段階にあるスプライソソームの様子をとらえている。つながれたエクソンが解放され、ループ型をしたラリアット(lariat)と呼ばれるイントロンがまだつながった状態になっている。
RNAの役割
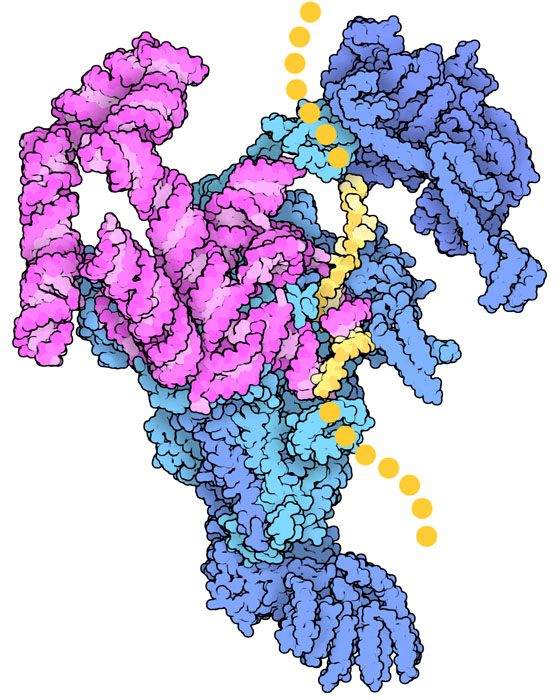
スプライソソームが行う詳細な仕事の多くは、小さなRNA鎖によって実行されている。この構造(PDBエントリー6n7p)はごく初期の反応段階をとらえたもので、スプライシング部位の一つが認識されたところである。スプライソソームのRNAは伝令RNA前駆体と対合し、つなぐ部分の配列を読み取る。そして別のタンパク質とRNAのサブユニットがこの複合体の周りに集まり、スプライソソーム全体がつくられる。これらのRNA鎖は、2つのマグネシウムイオンの助けを借り伝令RNAを切り貼りする反応も行う。驚くべきことに、自己スプライシングRNA(self-splicing RNA)の中にはこれと似たしくみを使い、スプライソソームの助けを借りずに自分自身で切り貼りできるものがある。
がんのつながり
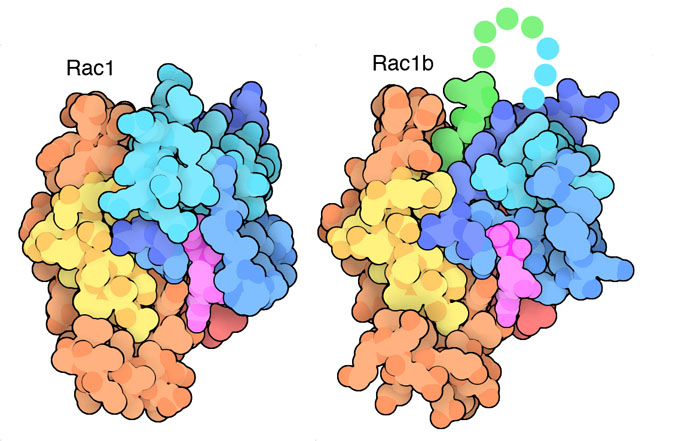
伝令RNAのスプライシングに問題があるとさまざまな病気の発生につながる。例えば、切り貼りされた区間が異なった信号タンパク質Rac1は、ある型のがんにおいてがん発症にある役割を果たしている。Rasタンパク質(Ras protein)と同様に、Rac1もGTPとGDPを使って「ON」と「OFF」を切り替える分子スイッチとして働き、細胞の成長と増殖を制御する信号を伝えている。Rac1は通常6つのエクソンで構成されている(ここに示すのはPDBエントリー1mh1)。一方、鎖の途中に余分なエクソンが追加された別の型(PDBエントリー1ryf)には、タンパク質をより継続的に「ON」の状態にする効果がある。がん細胞でRac1bが過剰に発現すれば、通常の制御を受けることなく増殖するのに役立つことになる。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
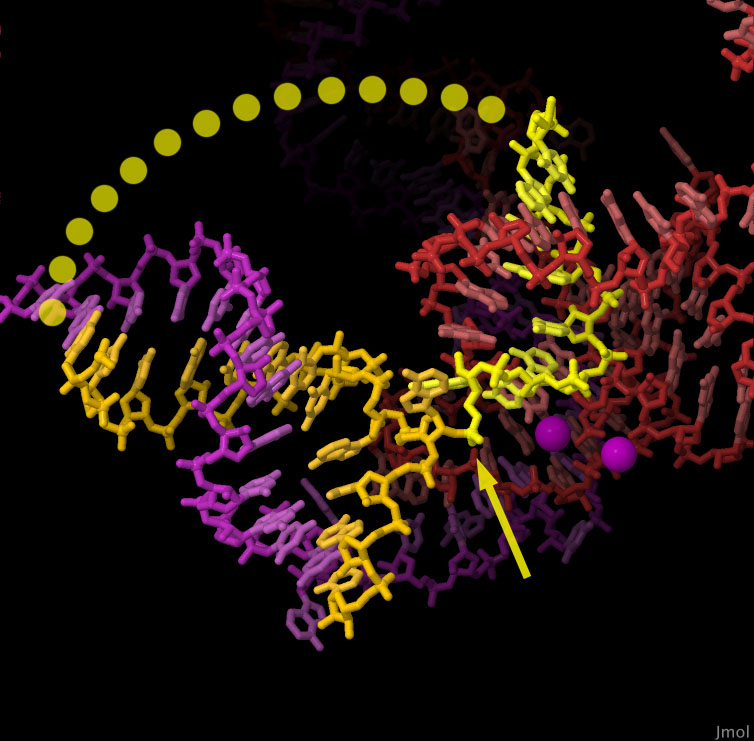
ここに示すスプライソソームの活性部位を拡大した図は、イントロンの「ラリアット」(黄)の末端がどのようにしてスプライソソームの中にある2つの小さなRNA分子(赤紫と赤)につかまれているのかを示している。イントロンは環をつくり、その末端はイントロンの途中へと戻ってRNAの2'位にあるヒドロキシル基(矢印で示す箇所)に付加されている。図示しているより前の反応段階で触媒として働く2つのマグネシウムイオンは、 RNA分子の近くに赤紫の球で示している。この構造をより詳しくみるため、図の下のボタンをクリックして対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- GenBankなどのデータベースを使って、例えばタイチン遺伝子ではどのようにエクソンとイントロンが配置されているのかを見ることができる。
参考文献
- 6n7p 2019 A unified mechanism for intron and exon definition and back-splicing. Nature 573 375-380
- 2019 RNA splicing by the spliceosome. Ann. Rev. Biochem. 89 1.1-1.30
- 2017 Cryo-electron microscopy snapshots of the spliceosome: structural insights into a dynamic ribonucleoprotein machine. Nat. Struct.Mol. Biol. 10 791-799
- 3jb9 2015 Structure of a yeast spliceosome at 3.6-angstrom resolution. Science 349 1182-1191
- 1ryf 2004 Alternative Splicing of Rac1 Generates Rac1b, a Self-activating GTPase. J.Biol.Chem. 279 4743-4749
- 1mh1 1997 The crystal structure of human rac1, a member of the rho-family complexed with a GTP analogue. Nat.Struct.Mol.Biol. 4 147-152
- 2010 The pathobiology of splicing. J. Pathol. 220 152-163
- 1994 Nobel Lecture: Split genes and RNA splicing. Cell 77 805-815
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









