185: タイチン(Titin)
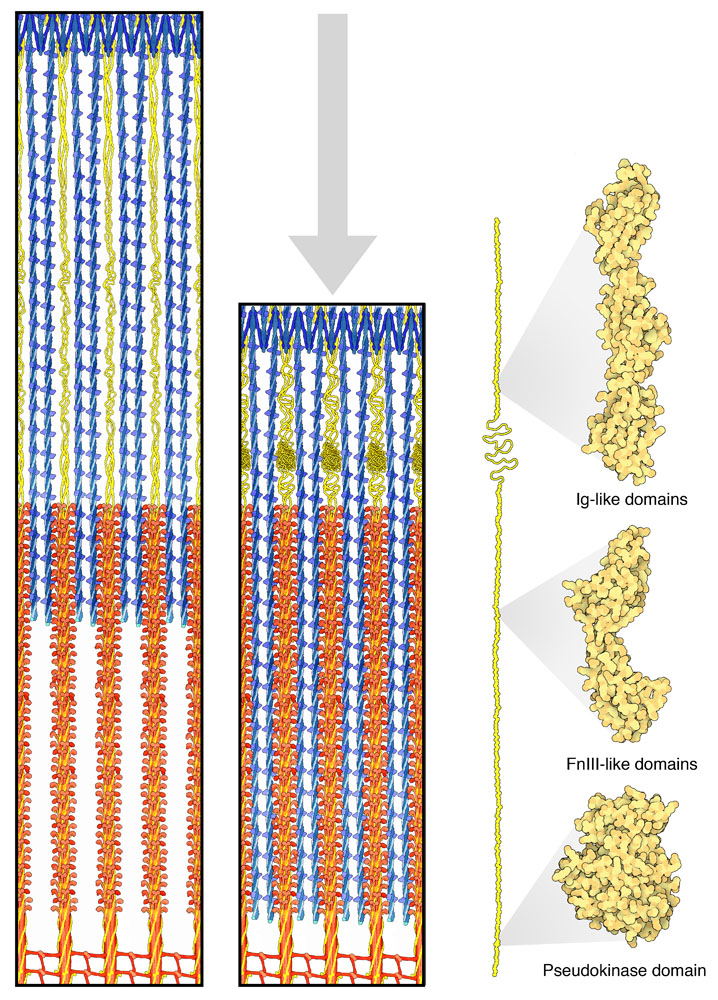
タイチン(titin)は私たちの体内では最も大きな鎖を持つタンパク質で、34,000個以上のアミノ酸でできている。この巨大なタンパク質は筋肉の中で大きな輪ゴムのように働く。一端はアクチン(actin)フィラメントでできたZ帯(Z disk、図の上部に青で示した部分)の一端に付加され、もう一方の端は、より太いミオシン(myosin)フィラメントでできたM線(M line、図の下部に赤で示した部分)に付加される。この2つの間にあるタイチン(黄色で示す部分)は伸びたり縮んだりする弾力のある構成部品が多数集まって構成されており、筋肉収縮の際に収縮装置全体を適切な形に保っている。
タイチンの解剖図
長いタイチン鎖は折りたたまれて、構成要素となる数百個のドメイン群になる。ほとんどのドメインは抗体(antibody)を構成しているドメインと似ている。PDBエントリー 2rik には3つのIg(Immunoglobulin、免疫グロブリン)様ドメインが含まれている。またフィブロネクチン(fibronectin)様ドメインも含まれるが、これは特にミオシンフィラメントと相互作用する部分で見られる。PDBエントリー 3lpw には2つのFnIII様ドメインが含まれる。タイチンにはいくつかの特別な配列がある。アミノ酸のプロリン(proline)が多く含まれる配列の繰り返しがPEVK領域にあって、中心付近に構造の定まらない区間(disorder segment)を作る。また、擬似キナーゼドメイン(pseudokinase domain)は鎖の末端付近に見られる(ここに示すのはPDBエントリー 1tki の構造)。
弾力のあるドメイン
タイチンは弾力性を出すのに特化している。タイチンの伸長は数段階の過程を経て起こる。日々の伸長は、Ig様ドメイン相互間にある小さな蝶番が全て伸びた時に起きている。力がかかっている時には中心にあるPEVK領域が伸び、力が緩むとその構造は解体されて絡み合った塊に戻る。より強い力がかかると、個々のドメインが解体されるが、これは筋肉の通常範囲内での動きの中で起こっていることだと考えられている。
タイチンのパートナー
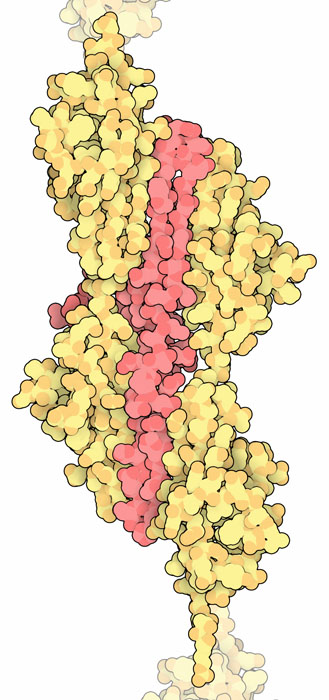
タイチンは何十個ものタンパク質と相互作用することにより、筋節(sarcomere)の構造を作り、動作を制御している。ここに示すのはそのような相互作用と相手となるタンパク質の一つテレソニン(telethonin、赤で示す部分、PDBエントリー 1ya5)である。これは隣接するタイチン分子の中にある最初のIg様ドメイン2つをくっつける。また(例え一部であったとしても)PDBに登録されている別のパートナータンパク質としてオブスクリン(obscurin、構成要素となる別の長いタンパク質で膜との結合を作る)、α-アクチニン(alpha-actinin、Z帯の構造を作る)、ミオメシン(myomesin、M線の構造を作る)がある。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
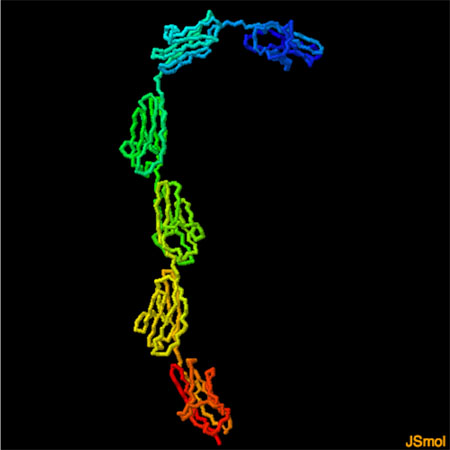
タイチンに含まれる個々のドメインは、短くて柔軟性のあるリンカーによってつながれており、構造全体としてはひもについているビーズのような見た目になっている。PDBエントリー 3b43 の構造には6つのIg様ドメインを伴った短い断片が含まれている。この曲がった形をした構造から、タイチン鎖の柔軟性について多少の知見を得ることができる。この構造についてより詳しく見るには、画像したのボタンをクリックし対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- ヒトのタイチンについて、RCSB PDBの「Protein Feature View」で見ると、タンパク質がどれぐらいの大きさなのか、分子のどの部分がPDBに登録されているのかなどが分かるでしょう。
- 柔軟性のあるタンパク質は、部品となるタンパク質ドメインを縦に繰り返し並べて作られていることが多いが、タイチンの場合はそのような構造はあまり多くありません。例えば、PDBで免疫グロブリン、フィブロネクチン、カドヘリンで検索してみてください。
参考文献
- 2014 Gigantic business: Titin properties and function through thick and thin. Circulation Research 114 1052-1068 DOI:10.1161/CIRCRESAHA.114.301286
- 2013 Structure of giant muscle proteins. Frontiers in Physiology 3 368 DOI:10.3389/fphys.2013.00368
- 3lpw 2010 The structure of the FnIII tandem A77-A78 points to a periodically conserved architecture in the myosin-binding region of titin. Journal of Molecular Biology 401 843-853 DOI:10.1016/j.jmb.2010.06.011
- 3b43、2rik 2008 A regular pattern of Ig super-motifs defines segmental flexibility as the elastic mechanism of the titin chain. Proceedings of the National Academy of Science USA 105 1186-1191 DOI:10.1073/pnas.0707163105
- 1ya5 2006 Palindromic assembly of the giant muscle protein titin in the sarcomeric Z-disk. Nature 439 229-233 DOI:10.1038/nature04343
- 1tki 1998 Structure basis of the activation of the titin kinase during myofibrillogenesis. Nature 395 863-869 DOI:10.1038/27603
代表的な構造
- 3b43: タイチン Ig様ドメイン
- タイチンは筋肉の構造を作り、弾力性を生み出している巨大なタンパク質である。この構造にはタイチンのIg様ドメインが6つ含まれている。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









