303: エノイルCoAカルボキシラーゼ/還元酵素(Enoyl-CoA Carboxylases/Reductases)
炭素固定(carbon fixation)は、非常に豊富に存在するが生物学的には利用しにくい分子である二酸化炭素(CO2)を、糖などの有機化合物に変換する重要な生物学的過程である。炭素固定の大部分は、植物や藻類によって、酵素のルビスコ(Rubisco)を通じて行われている。しかし、ルビスコは比較的遅くて効率の悪い酵素である。この効率の悪さが、ルビスコの大量生産や特殊な小器官(ピレノイドや葉緑体など)への貯蔵といった進化的適応を藻類や植物に促してきた。 ルビスコが非効率なのは、いずれも地球の大気中に高濃度で存在するCO2と分子状酸素(O2)の両方に対して親和性を持つところが大きい。ルビスコの効率を向上させるための様々な試みが行われているが、大幅な改善には至っていない。しかし、炭素固定を行うのは植物や藻類だけではない。ある種の細菌や古細菌は、ルビスコに依存しない別の炭素固定経路を進化させてきた。これらの系を研究すると、どのようにすれば大気中の二酸化炭素を捕えて固定するための人工的な合成系を構築できるかについてのヒントが得られ、それが大気中のCO2削減に向けた重要な一歩となるかもしれない。
炭素固定のより効率的な方法
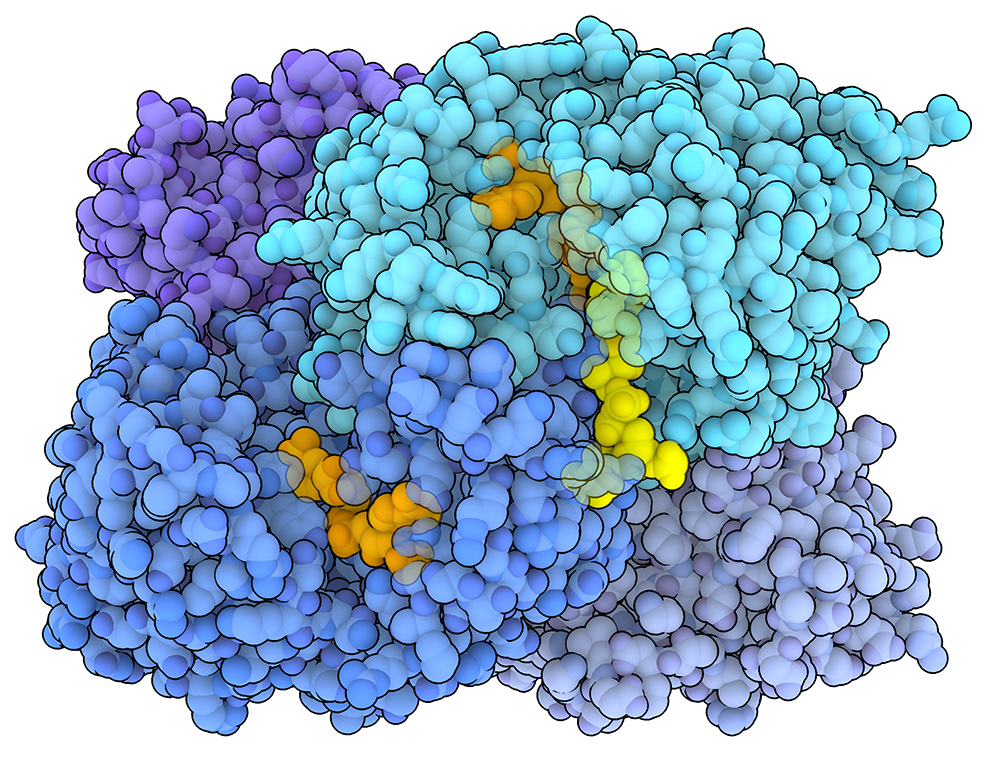
比較的最近発見されたエノイルCoAカルボキシラーゼ/還元酵素(enoyl-CoA Carboxylase/Reductase、ECR)として知られる酵素群は、ある種の細菌や古細菌に存在し、非常に速い速度で炭素固定を触媒することがわかった。キタサトスポラ・セタエ(Kitasatospora setae)と呼ばれる土壌細菌由来のECR(PDB 6OWE)を右に示す。ルビスコとは異なり、ECRは基質としてO2を受け入れないため、CO2との競合を考慮する必要がない。驚くべきことに、ECRは反応速度においてルビスコより最大10倍も優れていることが分かっている。最近の構造研究により、ECRはホモ4量体として機能し、各サブユニットはCO2、NADPH(補因子および電子供与体として働く)、基質分子(エノイル-CoA)に結合できることが示された。炭素固定化の際、水素化物イオン(hydride、H-)がNADPHから基質分子へと移される。この段階があることにより、基質の反応性が高くなり、結合した二酸化炭素と反応して新しい生成物(アルキル-CoAエステル、alkyl-coA ester)をつくれるようにしている。
酵素の同期
炭素固定におけるECRの驚異的な速度と効率の理由は何だろうか? 最近の研究で、迅速な触媒反応を促進する独特な同期のしくみが明らかになった。4量体のECRは「2量体のペア」という構成をとっていて、各サブユニットは隣のサブユニットと2量体を形成する。そして2つの二量体は「X」字型に配置されて組み合わさる。この特別な配置により、触媒サイクルにおいて協調して働くことができる。その様子を上の動画で示す。最初の空の状態(PDB 6NA3)において酵素は対称的な配置になっているが、NADPH(オレンジ色で示す部分)と結合すると、4量体は構造変化を起こす(PDB 6NA6)。各2量体を構成するサブユニットの一方が協調して閉じ、基質(黄色で示す部分)、NADPH、二酸化炭素(動画では示していない)を近接した位置で正確に配置し、炭素固定に備える(PDB 6NA4)。反応が完了すると、サブユニットが再び開いて生成物を放出する。この放出がきっかけとなって、2量体内にあるもう一方のサブユニットが閉じ、次の触媒反応が始まる。開いている状態と閉じている状態との間に行われる同調した切り替えは、酵素複合体のねじれ運動と連動しており、基質との結合や生成物の放出を促進すると考えられている。ECRのサブユニットが迅速に連動して同期することが、ルビスコよりも優れた性能を発揮する重要な要因であると考えられている。
構造をみる
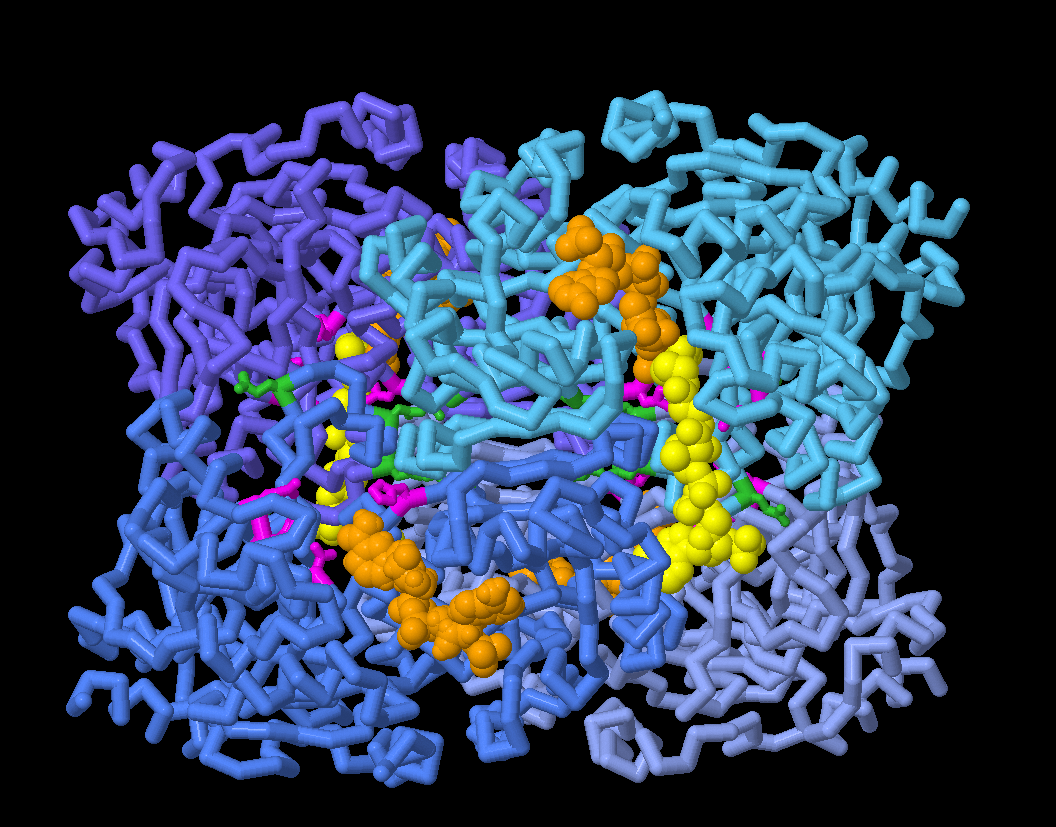
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
「対話的操作のできる画像」ボタンをクリックして画像を切り替えると、ECRのさまざまな配置の構造を探索し、二酸化炭素の結合に関与すると考えられるアミノ酸残基(赤紫色で表示)に加え、酵素の同期の調整に関与する残基(緑色で表示)も詳しく見ることができる。
理解を深めるためのトピックス
参考文献
- 6OWE 2019 Four amino acids define the CO2 binding pocket of enoyl-CoA carboxylases/reductases. Proc Natl Acad Sci U S A. 2019 Jul 9;116(28) 13964-13969
- 6NA3、6NA4、6NA5、6NA6 2022 Intersubunit Coupling Enables Fast CO2-Fixation by Reductive Carboxylases. ACS Cent Sci. 2022 Aug 24;8(8) 1091-1101
- 2016 A synthetic pathway for the fixation of carbon dioxide in vitro. Science Nov 18;354(6314) 900-904
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









