302: H5赤血球凝集素(H5 Hemagglutinin)
H5N1型の鳥インフルエンザ(avian influenza、bird flu)は、1996年の発生以来、世界中で何百万羽もの鳥の死亡と淘汰をもたらし、養鶏業界に多大な経済的損失をもたらすとともに、危険な野鳥の個体群に対する警戒心を高めてきた。最近の大流行では、鳥類だけでなく、野生動物や家畜の哺乳類にも病気を引き起こしている。
さまざまな亜型
赤血球凝集素(ヘマグルチニン、hemagglutinin)はスパイク状のタンパク質で、ノイラミニダーゼ(neuraminidase)とともにインフルエンザウイルスの表面を覆っている。現在、赤血球凝集素には18の亜型(H1からH18)、ノイラミニダーゼには11の亜型(N1からN11)が知られている。これらのタンパク質の組み合わせの違いによって、H1N1やH3N2といったウイルスの亜型が決まる。ヒトの場合はH1、H2、またはH3の赤血球凝集素を持つウイルスに感染することが最も多いが、鳥類はほぼすべての赤血球凝集素亜型を発現するウイルスに感染する可能性がある(コウモリから分離されたH17とH18を除く)。しかし、鳥類で重篤な病気を引き起こすのは、2つの赤血球凝集素亜型、H5とH7だけである。
糖の特異性
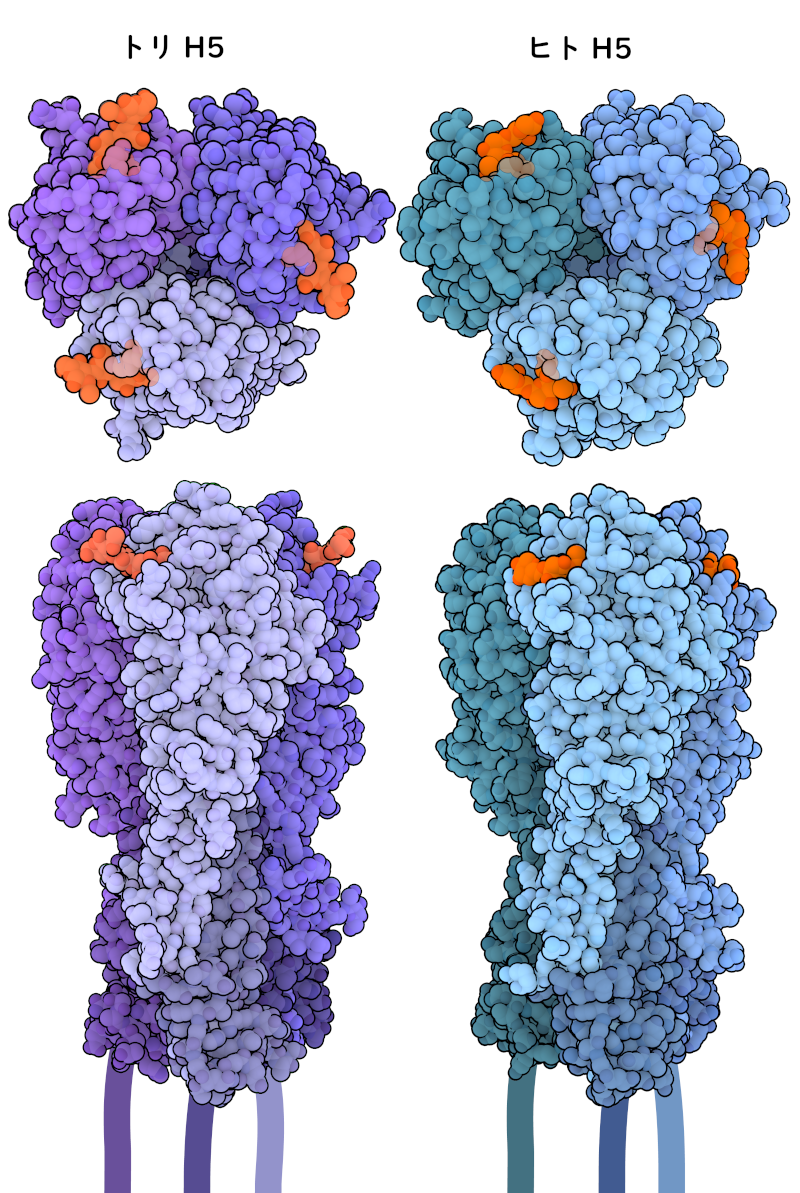
インフルエンザは、細胞表面にある特定の分子を認識して結合する赤血球凝集素の働きによって細胞内に侵入し、感染することができる。ほとんどの赤血球凝集素はシアル酸(sialic acid)を標的とすることが分かっている。このシアル酸は、9個の炭素を持つ糖分子の一種で、細胞表面にあるタンパク質や脂質に付加されているグリカン(glycan、糖鎖)の末端でよく見られる。グリカンとはさまざまな方法で結合することができるが、最もよく見られる結合型はα2,3結合とα2,6結合である。H5N1やH7N9のような鳥インフルエンザウイルスは、α-2,3結合のシアル酸受容体との結合に適応しており、鳥類では呼吸器や消化管においてこの受容体が多く見られる。鳥類のH5は図の左側に紫色で示す(PDB ID 1JSN)。ヒトの場合、上気道(鼻、のど、気管)にある細胞の大部分がα-2,6結合シアル酸受容体を持っている。H1N1(H1は青色で示す、PDB ID 1RVT)のようなヒトインフルエンザウイルスは、これらの受容体への結合に適応しており、ヒト同士の間でより容易に感染するようになっている。
種の壁を越える
H5N1は鳥類を好むにもかかわらず、ヒトや他の哺乳類にも感染することが知られている。このような感染は通常、養鶏場や生きた鳥の市場などの混みあった環境において感染した鳥と直接接触することによって起こる。H5N1のヒトからヒトへの感染は非常にまれで非効率的であるが、最近、米国内の複数の乳牛農場でH5N1の感染が発生するなど、哺乳類間での感染事例が多数報告されている。牛の乳腺にはα-2,3結合シアル酸受容体が豊富に存在するため、H5N1が乳汁中に複製・放出され、汚染された搾乳器具を通じて他の牛に感染する可能性のあることが研究で示されている。
糖衣細胞を作る
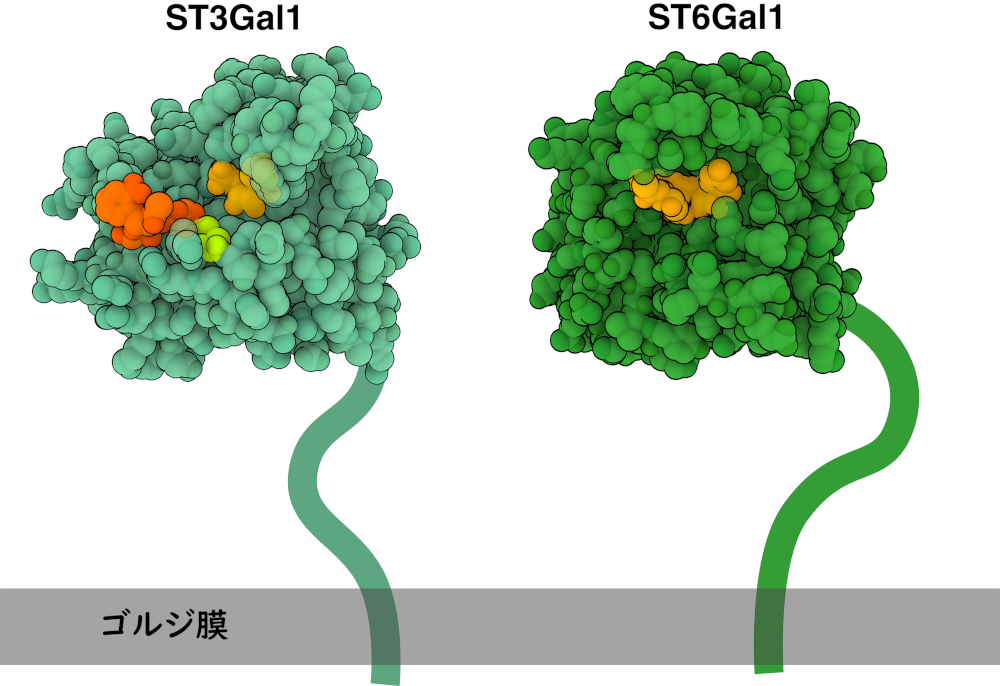
シアル酸はどのようにして細胞表面分子に付加されるのだろうか? これは、CMP-シアル酸のようなドナー分子から糖タンパク質や糖脂質のようなアクセプター分子にシアル酸を転移するシアル酸転移酵素(sialyltransferase)の作用によって行われる。この酵素はゴルジ体膜上にあって、形成するグリコシド結合の種類によっていくつかのサブファミリーに分類される。α-2,3-シアル酸転移酵素(ST3Gal1など、PDB ID 2WNB、薄い緑色で表示)はα-2,3結合を介してシアル酸をガラクトース(galactose)に付加する。一方、α-2,6-シアル酸転移酵素(ST6Gal1など、PDB ID 6QVT、濃い緑色で表示)は、α-2,6結合を介してシアル酸をガラクトースに付加する。細胞表面のシアル酸付加は、細胞認識、信号伝達、分化など多様な過程に関与しており、ウイルスの理想的な標的となっている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
研究により、たった一つのアミノ酸の変化によって、H5が鳥類(α-2,3結合)受容体ではなく、ヒト・哺乳類(α-2,6結合)受容体へと優先的に結合することが示された。具体的には、通常はグルタミン(glutamine)である226番残基がロイシン(leucine)に変わると、哺乳類受容体に結合しやすくなる疎水性環境ができる。図の下のボタンをクリックして対話的操作のできる画像に切り替え、通常のH5(PDB ID 4K63、4K64)と変異型H5(PDB ID 4K66、4K67)が鳥類とヒトの受容体に対しどのように結合するかを比較してみて欲しい。
理解を深めるためのトピックス
参考文献
- 1JSN 2001 X-ray structures of H5 avian and H9 swine influenza virus hemagglutinins bound to avian and human receptor analogs. Proc Natl Acad Sci U S A. Sep 25;98(20) 11181-11186
- 1RVT 2004 The structure and receptor binding properties of the 1918 influenza hemagglutinin. Science Mar 19;303(5665) 1838-1842
- 2WNF 2009 Structural insight into mammalian sialyltransferases. Nat Struct Mol Biol. Nov;16(11) 1186-1188
- 6QVT 2020 Unliganded and CMP-Neu5Ac bound structures of human α-2,6-sialyltransferase ST6Gal I at high resolution. J Struct Biol. Nov 1;212(2) 107628
- 4K63, 4K64, 4K66, 4K67 2013 An airborne transmissible avian influenza H5 hemagglutinin seen at the atomic level. Science 2013 Jun 21;340(6139) 1463-1467
- 2013 Receptor binding and pH stability - how influenza A virus hemagglutinin affects host-specific virus infection. Biochim Biophys Acta. 2014 Apr;1838(4) 1153-1168
- 2024 Spillover of highly pathogenic avian influenza H5N1 virus to dairy cattle. Nature 634 (Jul 25) 669–676
- 2023 The vertebrate sialylation machinery: structure-function and molecular evolution of GT-29 sialyltransferases. Glycoconj J 40 473–492
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









