276: 點擊化學(Click Chemistry)
了解蛋白質和核酸的結構,使我們有能力通過使用抑製劑阻斷它們或用非天然的化學基團修飾以達到控制它們的目的。這是以結構為導向的藥物發現的基礎,目前許多重要的治療藥物都是通過這種方法發現的。然而,然而,最大的挑戰之一是生物分子具有復雜的形狀,與它們結合的分子必須具有類似的特定形狀。今年的諾貝爾化學獎被授予了三位研究人員,他們率先採用模塊化的化學方法,幫助研究人員合成具有所需形狀和特性的各種分子。
分子型樂高積木
點擊化學(click chemistry)允許研究人員通過連接模塊化前體來構建定制分子。建立這些聯繫的訣竅是找到通常不反應但可以在適當條件下"點擊"在一起的化學基團。 Sharpless和Meldal實驗室獨立地發現,使用銅作為催化劑,具有疊氮基(azide)的化合物可以與具有炔烴(alkyne)的化合物連接。當它們反應時,這兩個化學基團形成一個特有的五元環三唑(triazole),連接兩個分子。
讓酶來選擇
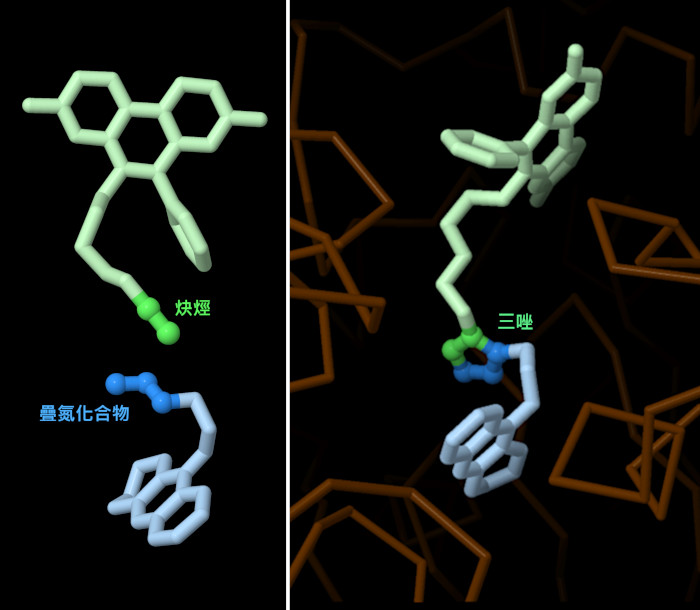
令人驚訝的是,Sharpless實驗室已經表明,一種酶可以在不需要銅的情況下進行這種相同的反應。這兩個分子都與蛋白質結合,使疊氮基和炔烴接近並促進反應。在他們的經典實驗中,他們將多對帶有疊氮基或炔基的前體添加到乙酰膽鹼酯酶(acetylcholinesterase)中,發現該酶只連接了最好的一個。使用這種方法,該酶產生了一種抑製劑,其結合比任何其他先前已知的非共價抑製劑更緊密,如此處顯示的PDB條目1q83 的化合物所示。這種反應也發生在活細胞中,探針和傳感器可以與細胞中的蛋白質相連。 Bertozzi實驗室開發了一系列對細胞友好的點擊反應,例如,通過將炔烴嵌入緊張的分子環中來消除對有毒銅催化劑的需求。
古怪的建築風格
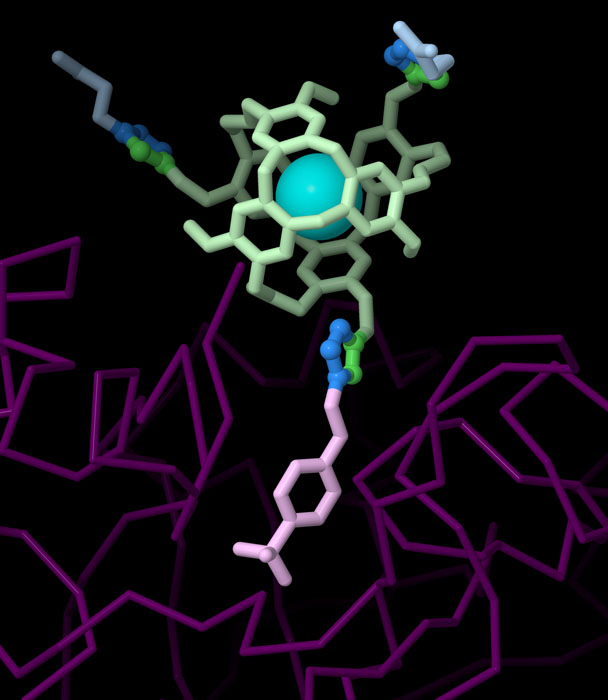
點擊化學是合成化學中使用的一組方法的核心。點擊化學被廣泛用於組合化學,許多元素在不同組合中的效力都可以被快速研究。它也被用作一種有針對性的合成方法,以實現研究人員所希望的夢想分子。這裡介紹的分子(PDB條目3cyu)被設計為一個生物傳感器。頂端的球形隱烷(cryptophane)有一個點擊反應的烷基分子,可以捕獲氙原子(xenon atoms),這被認為是核磁共振成像中有用的對比劑。底部的疊氮化物部分是一種分子,能與目標酶碳酸酐酶 II(carbonic anhydrase II)特異性結合。
探索結構
要切換到有互動控制的頁面,請點擊圖表下面的按鈕。如果加載沒有開始,請嘗試點擊圖表。
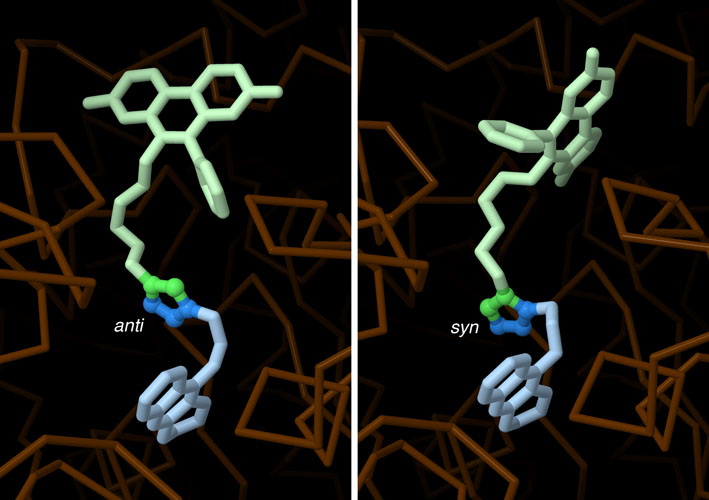
疊氮化物和炔烴前體之間的點擊化學可以產生兩種略有不同的三唑,即反(anti)和順(syn)類型,這取決於它們在反應過程中如何相互排列。當使用銅作為催化劑時,大多數三唑類化合物具有反構型,兩個連接的前體從五元環上向相反方向延伸(PDB條目1q84)。然而,在上述由乙酰膽鹼酯酶催化的反應下,前體大多並排排列形成順式三唑(PDB條目1q83)。正如預期的那樣,生化測試表明,這種順式化合物與酶的結合比反化合物更緊密。按下圖片下方的按鈕,可以切換到互動式可操作的圖片,並仔細觀察兩者的結構。
進一步的討論議題
- 許多點擊化學抑製劑被收錄在PDB檔案中,可以通過RCSB PDB高級搜索中的Chemical Sketch Tool查找。例如,搜索SMILES字符串"CN1C=C(C)N=N1"。
- 與乙酰膽鹼酯酶結合的炔烴和疊氮前體可以在PDB條目5eih中查看。
參考文獻
- 3cyu 2008 Structure of a 129Xe-cryptophane biosensor complexed with human carbonic anhydrase II. J Am Chem Soc 130 6942-6943
- 2005 Chemistry in living systems. Nat Chem Biol. 1 13-21
- 1q83, 1q84 2004 Freeze-frame inhibitor captures acetylcholinesterase in a unique conformation. Proc Natl Acad Sci U S A 101 1449-1454
- 2003 The growing impact of click chemistry on drug discovery. Drug Discov Today 8 1128-1137
- 2002 Click chemistry in situ: Acetylcholinesterase as a reaction vessel for the selective assembly of a femtomolar inhibitor from an array of building blocks. Angew Chem Int Ed 41 1053-1057
 生物大分子學習的教育門戶
生物大分子學習的教育門戶 









