213: サーチュイン(Sirtuins)
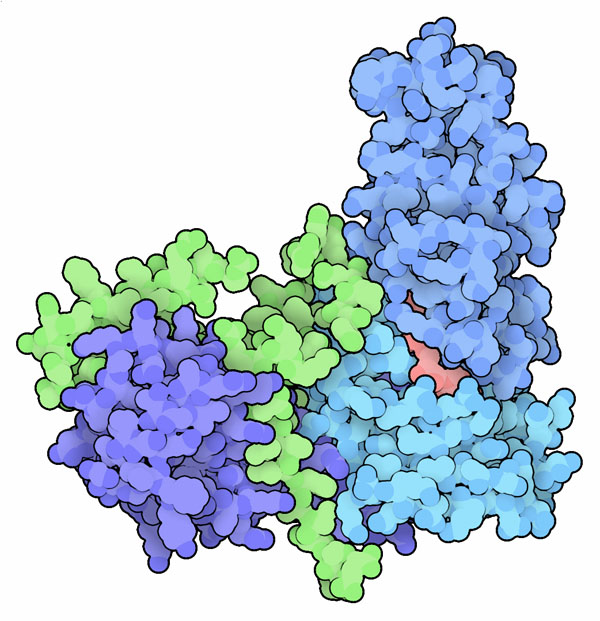
Sir2と呼ばれるよく分わかっていない遺伝子の研究で、あることが明らかになりつつある。Sir2を通常より多く発現するよう改変を加えた酵母細胞は、普通の細胞より30%長く生きたのだ。この発見により、このタンパク質は何をしどのようにして酵母の老化に影響しているのかについて関心が高まった。また、恐らく私たち自身の細胞の老化にも影響しているものと考えられた。そしてすぐに、Sir2がヌクレオソーム(nucleosome)からアセチル基を除去し、染色質(chromatin)の中で不活性化したい遺伝子領域をより強固にする酵素であることが分かった。似たタンパク質がほぼすべての生物から見つかっており、これらをまとめてサーチュイン(sirtuin)と呼ばれている。
サーチュインの仲間たち
私たちの細胞では7種類のサーチュインが作られていて、それぞれSIRT1~SIRT7と呼ばれている。これらは様々な役割を担っていて、ある種のサーチュインはヒストンを修飾し転写を制御する標準的な役割をしている。また細胞質やミトコンドリアにある別のサーチュインは、代謝や神経変性などの広範囲な過程の制御に関係している。アセチル基の除去に特化したものもあれば、脂質のようにより大きな分子を除去するものや、新たな修飾を行うものもある。これらの分子を研究し続けることにより、多くの生物における老化と強く関係していることがより明らかになってきた。
サーチュインの構造
サーチュインはよく知られた補因子を使って珍しい反応を行う。通常は電子伝達系に関係する補因子NADを取り込み、この分子の特徴的部分であるニコチンアミド環を除去する。次に、対象となるタンパク質からアセチル基を取り出し、残ったNADの断片に付加する。Sir2(PDBエントリー4iao)で見られるようなサーチュインの構造には独特のものがある。NADをつかんでその横にアセチル化されたリジンを並べ転移反応を触媒する二つのドメインがある。さらなるドメインを持つサーチュインもあって、それらは別の制御タンパク質と相互作用する。ここに示す構造に含まれるSir4などがその例である。
アンチエイジング化合物
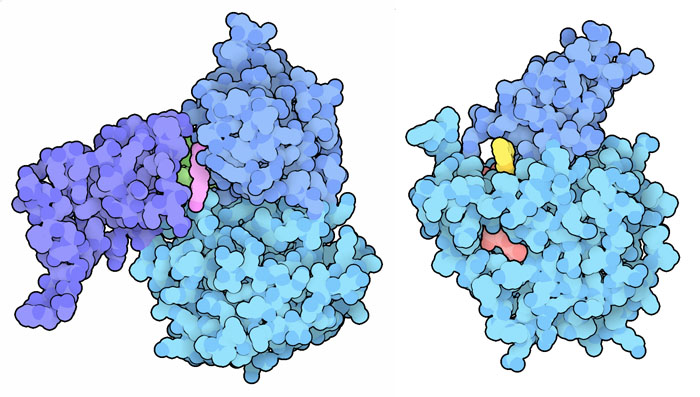
サーチュインと老化の関係が見つかり、サーチュインの活性を促す物質を探すこと次の研究課題となった。ぶどうの表皮やその他の果実に含まれる天然の化合物の一つレスベラトロール(Resveratrol)がその最初の候補として挙げられ、メディアなどで広く(そして恐らく誇張して)宣伝された。SIRT1に結合したレスベラトロールの構造(PDBエントリー5btr)は、アロステリック的に働き(=活性部位とは異なる場所に結合し構造を変容させることで活性に影響与え)、タンパク質のドメインが閉じるのを助けて活性を促進するのかもしれないことを示している。この他にも何千種類もの化合物が試された。例えば、PDBエントリー5mf6に含まれる化合物はSIRT6に対する選択的な活性化因子で、似たアロステリックなしくみを使うことがこの構造から分かる。
構造をみる
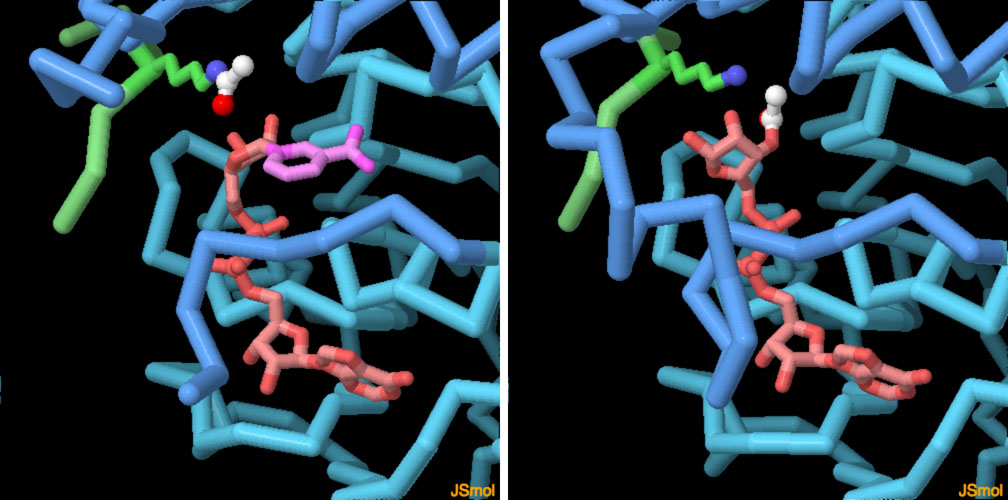
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ここに示す2つの構造は、反応前と反応後2つのサーチュインの構造である。左に示すのはp53腫瘍抑制因子(p53 tumor suppressor、PDBエントリー2h4f)に由来する小さなペプチドがNADとともに活性部位に結合している構造である。アセチル化されたペプチド中のリジンが酵素によってつかまれ、NADの近くに配置されている。反応後、アセチル基はNADに移され、その過程でニコチンアミド環(反応前の構造では赤紫で示した部分)が放出される(PDBエントリー2h59)。画像の下にあるボタンをクリックして対話的操作のできる画像に切り替え、構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- ヒト由来のサーチュインが決定されています。生物種をヒトに限定してサーチュインを検索し、それらを探してみてください。
- サーチュインは柔軟な分子で、反応の過程で開いたり閉じたりします。構造比較ツールを使って、例えば状態の異なるSIRT2の2つの構造(1j8fと3zgv)を比較し、この柔軟性を見てみてください。
参考文献
- 5mf6 2017 Structural basis of Sirtuin 6 activation by synthetic small molecules. Angewandte Chemie 56 1007-1011
- 2016 Slowing ageing by design: the rise of NAD+ and sirtuin-activating compounds. Nature Reviews Molecular Cell Biology 17 679-690
- 2016 Human sirtuins: structures and flexibility. Journal of Structural Biology 196 534-542
- 5btr 2015 Structural basis for allosteric, substrate-dependent stimulation of SIRT1 activity by resveratrol. Genes Development 29 1316-1325
- 4iao 2013 Structural basis for allosteric stimulation of Sir2 activity by Sir4 binding. Genes Development 27 64-73
- 2h4f, 2h59 2006 Insights in the sirtuin mechanism from ternary complexes containing NAD(+) and acetylated peptide. Structure 14 1231-1240
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









