214キメラ抗原受容体Chimeric Antigen Receptors
免疫系(immune system)は私たちを危険から守ることに熟達してはいるが、がん細胞に立ち向かう時はしばしば対処に失敗してしまう。がん細胞は通常のヒト細胞が悪者に変化したものである。これらは通常、さまざまな遺伝的変化を経て正常な状態での制約を回避し成長できるようになった細胞である。そして残念ながら、このような遺伝的変化のほとんどはがん細胞の内部にあるタンパク質を変異させるので、免疫系はそれを検知することができない。今日、ある特定の型のがんに対抗できるよう免疫系を再編した方法の開発が進められている。
改変を加えたT細胞
T細胞はT細胞受容体を使ってウイルスに感染した細胞を認識し、それを破壊することができる。ただ残念なことに、T細胞はがん細胞に対してはあまり効果を発揮できない。なぜならがん細胞の表面にある分子は正常細胞の表面でも見られることが多いからである。キメラ抗原受容体(CAR)はT細胞ががん細胞を認識できるようにするための一手段である。がん患者からT細胞を取り出し、患者のがんを認識するCARの遺伝子を加える。こうしてできたキメラ抗原受容体T細胞(CART)を患者に戻せば、がん細胞を探し出しやっつけてくれる。
CARをつくる
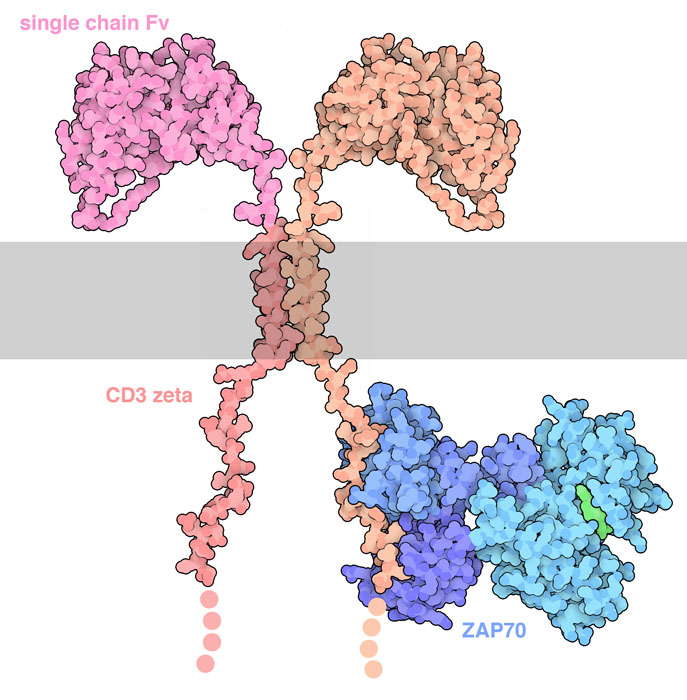
キメラ抗原受容体はそれぞれ特有の機能を持つ何種類かのタンパク質に由来する機能部位をつなぎ合わせて作られる。単鎖抗体可変断片(Fv)は腫瘍を標的とする既に知られたがん細胞タンパク質を認識する。これらは通常、モノクローナル抗体の先端にあるドメインだけを用い、柔軟な接続鎖(リンカー)で二つの鎖をつないで作られる。抗体部分は別の柔軟なリンカーを介して膜貫通領域につなげられる。細胞内では信号伝達タンパク質から一つまたはそれ以上のドメインが取り出され、T細胞は腫瘍細胞を見つけると活性化される。
CARTが活動する様子
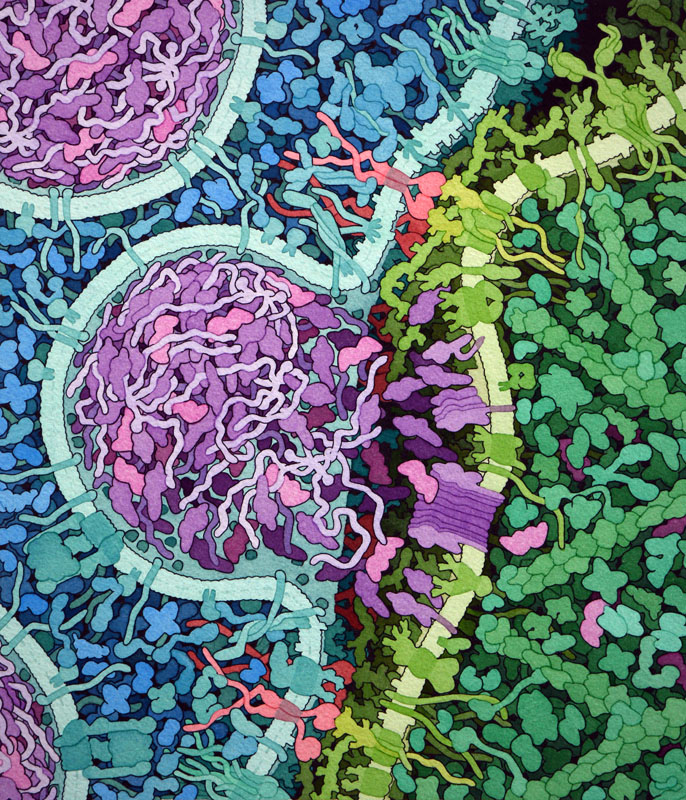
特に子どもによくみられるある型の白血病の治療に用いるCART治療薬チサジェンレクリューセル(tisagenlecleucel)が、最近米国FDA(アメリカ食品医薬品局)で承認された。急性リンパ性白血病(acute lymphoblastic leukemia、ALL)として知られるこの白血病では、通常のB細胞ががん細胞に変化し正常に発達しなくなっている。CART治療において、通常はB細胞の表面で見られこの変異した白血球細胞の表面でも見られるCD19というタンパク質を対象とする。キメラ抗原受容体は上記のモデルよりも少し改良されていて、4種類の部分で構成されている。この構成要素は、単鎖抗体、柔軟な接続鎖、CD8α由来の膜貫通部位、CD3
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
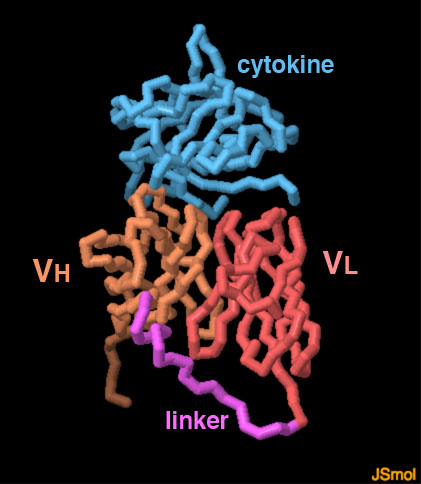
単鎖抗体はモノクローナル抗体の重鎖と軽鎖をつなぐ接続部分を改変してつくられる。通常は抗体の先端部にある可変ドメイン(VL、VHと表記した部分)だけを用い、接続部分はアミノ酸のグリシンとセリンでできた柔軟な鎖(赤紫の部分)とする。ここに示す構造では青で示すサイトカイン(cytokine)やインターロイキン-1 β(interleukin-1 beta)と結合している。図の下のボタンをクリックして対話的操作のできる画像に切り替え、より詳しく構造を見てみて欲しい。
理解を深めるためのトピックス
- PDBには単鎖抗体Fvの構造が多数登録されています。それらを見てみると、そのほとんどは2つの鎖をつなぐ改変型接続部の原子座標が含まれていないことに気づくでしょう。それはどうしてでしょう?
- T細胞の細胞傷害性のしくみについてより詳しくみるには、PDBに登録されているパーフォリンやグランザイムの構造を見てみるといいでしょう。
参考文献
- FDA Briefing Document BLA 125646, Tisagenlecleucel Novartis Pharmaceuticals Corporation
- 2017 CARs: Synthetic immunoreceptors for cancer therapy and beyond. Trends in Molecular Medicine 23 430-450
- 2013 Gene-engineered T cells for cancer therapy. Nature Reviews Cancer 13 525-541
- 2kh2 2009 High resolution NMR-based model for the structure of a svFv-IL-1beta complex. Journal of Biological Chemistry 284 31928-31935
- 2ozo 2007 Structural basis for the inhibition of tyrosine kinase activity of ZAP-70. Cell 129 735-746
- 2hac 2006 The structure of the zetazeta transmembrane dimer reveals features for its assembly with the T cell receptor. Cell 127 355-368
- 2oq1 1995 Molecular basis for the interaction of ZAP-70 with the T-cell receptor. Nature 377 32-38











