212: グルタチオン転移酵素(Glutathione Transferases)
細胞は紛らわしいごちゃごちゃした低分子で満ちあふれている。その中には危険な分子が混ざりこんでいることがあるため、細胞はそれを見つけ出し除去する方法を備えておく必要がある。最初の防衛線では、 とらえにくい炭素を豊富に持つ毒に対しシトクロムp450(cytochrome p450)のような酵素が修飾を行い、より水に溶けやすくする。第2の防衛線では、グルタチオン転移酵素(glutathione transferase)により便利な取っ手が不要分子にくっつけられ、これが細胞の排出機械によって認識される。
分子のハンドル
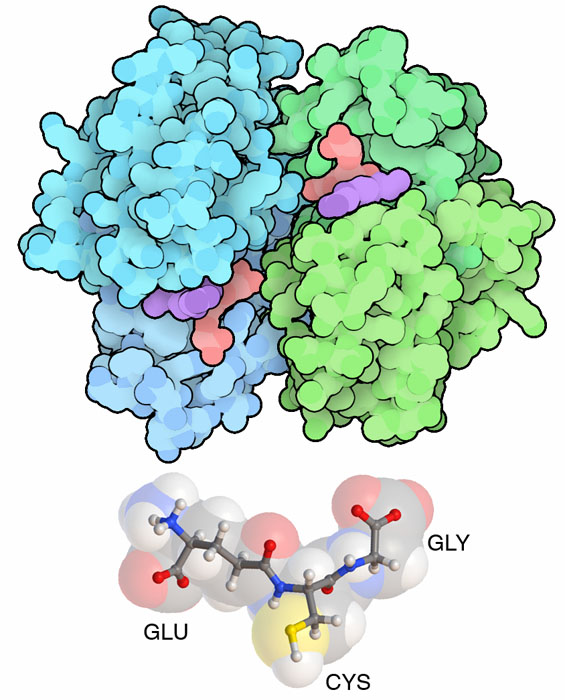
役に立つ分子ハンドルをつくるコツは2つある。まず、ハンドルは認識できしかも細胞内で他の分子と区別できる必要がある。グルタチオンは3つのよくあるアミノ酸(グルタミン酸、システイン、グリシン)でできているが、通常のペプチドと混同されることはないだろう。なぜなら、グルタミン酸は通常とは異なる方法で付加され、側鎖で共有結合が形成されているからである。次に、分子ハンドルは簡単な化学的方法で他の分子に付加できる必要がある。グルタチオンは中心(システインの一部)に硫黄原子を持っている。これは容易に活性化され、さまざまな別の分子に付加できる。
一緒に働く
20種余りのグルタチオン転移酵素群が一緒になって働き、細胞から毒を洗い流す。ここに示す構造(PDBエントリー3gss)はその中で最もよく研究されているものの一つでhGSTP1-1と呼ばれている。 20種の酵素が、細菌や菌類が作る毒素、食べ物を料理したりタバコを吸ったりする時に作られる活性分子、その他さまざまな環境由来の汚染物質といった多くの危機から私たちを守ってくれる。このため、それぞれのグルタチオン転移酵素は通常、多様な外来分子を認識し、それらすべてにグルタチオンを付加する。この仕事は肝臓細胞などの一部細胞にとっては大変重要で、細胞に含まれるグルタチオン転移酵素の量は細胞内全タンパク質の10%にまで達することがある。
蚊とDDT
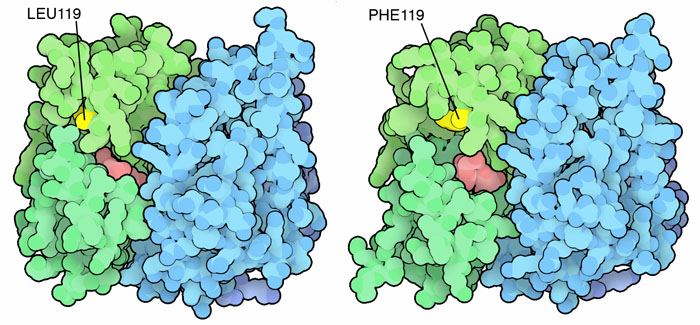
無毒化の過程は攻撃側と防御側との間で繰り広げられる軍拡競争になることがある。一例について最近研究されているが、それはアフリカにいるマラリアを持った蚊に関するものである。DDT(ジクロロジフェニルトリクロロエタン)は蚊の駆除に広く用いられているが、殺虫剤としてDDTが多用されている地域ではDDT抵抗性の蚊が現れている。このような蚊を調べてみると、抵抗性を持つようになる方法の一つは変異型のグルタチオン転移酵素をつくることであることがわかった。皮肉にも、この変異によって一つのロイシンがよりサイズの大きいフェニルアラニンに入れ替わるが、これによりタンパク質の折りたたまれ方が少し変わり、より大きな活性部位ができて大きなDDT分子がはまるようになる(PDBエントリー3zml、3zmk)。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
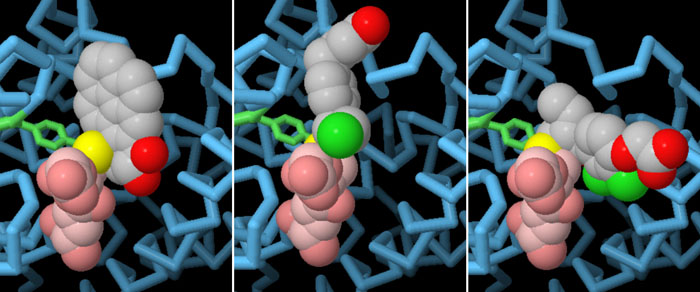
グルタチオン転移酵素は薬剤の無毒化においても中心的な役割を果たしている。ここには3つの構造を示す。すべて同じ酵素で起こりうることである。PDBエントリー3pgtは、強力な発がん物質を無毒化している酵素の構造をとらえている。PDBエントリー3cshの構造は、酵素が抗がん剤にグルタチオンを付加し効果を減らしているところを示している。このような問題に対処し薬の効き目を長びかせるには、PDBエントリー3gssに含まれるような阻害剤を薬と一緒に投与し酵素の活性を抑えればよい。図の下のボタンをクリックして対話的操作のできる画像に切り替え、より詳しく構造を見てみてほしい。
理解を深めるためのトピックス
- さまざまなグルタチオン転移酵素の構造が決定され、PDBに登録されています。グルタチオン転移酵素で検索しそれらを探してみてください。
- これらの酵素は通常2つのドメインで構成されています。一方はグルタチオンに結合し、もう一方は対象分子と相互作用します。これらの酵素をみるとき、リボン表現や主鎖表現で分子を表示し2つのドメインを見てみてください。
参考文献
- 3zmk, 3zml 2014 A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology 15 R27
- 2013 Glutathione transferases, regulators of cellular metabolism and physiology. Biochimica et Biophysica Acta 1830 3267-3288
- 2012 Human cytosolic glutathione transferases: structure, function, and drug discovery. Trends in Pharmacological Sciences 33 656-668
- 2011 Glutathione transferases: a structural perspective. Drug Metabolism Reviews 43 138-151
- 3csh 2008 The anti-cancer drug chlorambucil as a substrate for the human polymorphic enzyme glutathione transferase P1-1: kinetic properties and crystallographic characterization of allelic variants. Journal of Molecular Biology 380 131-144
- 2005 Glutathione transferases. Annual Review of Pharmacology and Toxicology 45 51-88
- 3pgt 1999 Structure and function of residue 104 and water molecules in the xenobiotic substrate-binding site in human glutathione S-transferase P1-1. Biochemistry 38 10231-10238
- 3gss 1997 The three-dimensional structure of the human Pi class glutathione transferase P1-1 in complex with the inhibitor ethacrynic acid and its glutathione conjugate. Biochemistry 36 576-585
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









