69: コレラ毒素(Cholera Toxin)
細菌は自己を守る闘いにおいて手加減はしない。ある細菌は1個の分子で1つの細胞を完全に殺すことができるぐらい強力な毒素を作る。これはシアン化物(cyanide)やヒ素化合物(arsenic)のような化学的な毒よりもずっと効力があるものである。化学的な毒物は分子1個につき重要な分子を1個ずつ攻撃していくので、細胞1個を殺すには非常に多くのシアン化物やヒ素化合物の分子が必要なのである。細菌の毒はこの化学的毒物よりもはるかに致死的な毒とするために2つの戦略を用いている。
致死的な毒素の形成
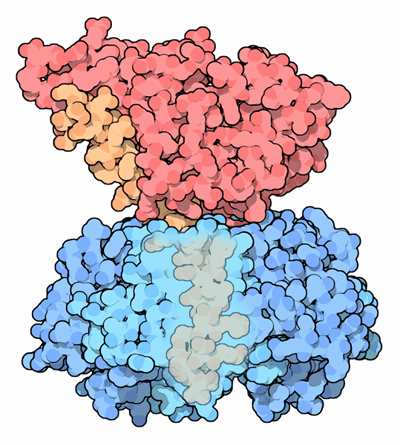
極めて致死的な毒素を作るのに使われる最初の方策は、毒素を不幸な細胞へ直接運び込むのに標的機構(targeting mechanism)を用いるというものである。ここに示したコレラ毒素(cholera toxin、PDBエントリー 1xtc)は青で示す5つのタンパク質鎖による環を持っていて、これが細胞表面の炭水化物に結合する。これが赤で示した分子の有毒部分を細胞へ運び込んで大惨事を引き起こす。
毒素を致死的にする2つ目の方策は、化学的な毒素の代わりに有毒な酵素を使うというものである。酵素は何度も反応を行うよう設計されており、反応対象の間を飛び回って化学変化を起こしていく。そのため1個の酵素が細胞全体の分子を変化させることができる。コレラは一旦細胞内に入り込むとこの方策を使う。有毒部分は分子から分子へと飛び回り、一つずつ次々に働かなくしていく。そしてついに細胞全体がやられてしまう。
作用中のコレラ毒素
コレラ毒素の触媒作用部分が行う機能は1つだけである。その機能とは、細胞の信号伝達に使われるGタンパク質(G Protein、2004年4月「今月の分子」参照)を見つけ出し、それにADP分子を付加することである。これによりGタンパク質は常時活性状態となり、信号を送り続けることになる。それで細胞は混乱し、そして特に大量の水とナトリウム(sodium)を細胞外へと輸送し始める。これが腸にあふれ出し、生命を脅かす脱水を引き起こす。
恐ろしい毒
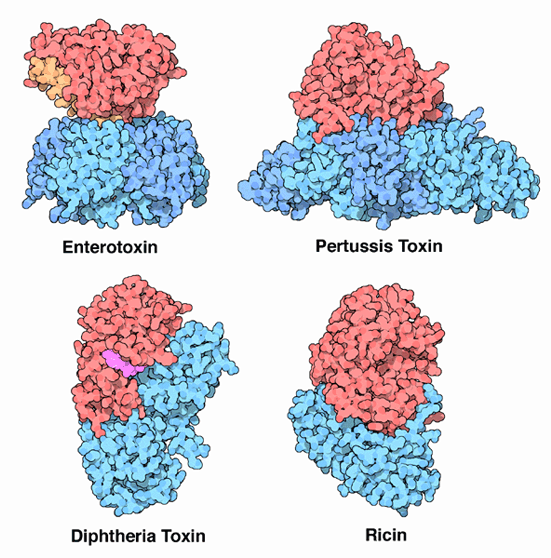
コレラ毒素が利用している2つの部分を使ったやり方は大変効果的なので、自分自身を守る方法を探す他のさまざまな生物でも利用されている。PDBに登録されている例をいくつかここに示す。標的細胞に結合する部分は青で、有毒酵素部分は赤で表示している。左上に示す大腸菌(E. coli)のエンテロトキシン(enterotoxin、PDBエントリー 1ltb)は見た目と行動がコレラ毒素と似ており、旅行中に腸の疾患を引き起こす。右上に示す百日咳毒素(pertussis toxin、PDBエントリー 1prt)は百日咳を引き起こす細菌によって作られ、コレラ毒素と同様にGタンパク質による信号伝達経路を攻撃する。左下に示すジフテリア毒素(diphtheria toxin、PDBエントリー 1mdt)は1本鎖として合成されるが、放出される際に2つに分断されて2つの部分から成る毒素が形成される。この毒素は伸長因子(elongation factor)の一つを攻撃することによって細胞におけるタンパク質合成を止める。右下に示すリシン(ricin、ヒマ毒、PDBエントリー 2aai)はトウゴマ(castor bean)によって作られる強力な毒素である。一旦細胞内に入ると、リボソーム(ribosome)を直接攻撃することによってタンパク質合成を阻害する。なお、遺伝的視点から見たこれらの毒素に関する追加情報が、欧州バイオインフォマティクス研究所(EBI)の「今月のタンパク質」で提供されている。
構造をみる
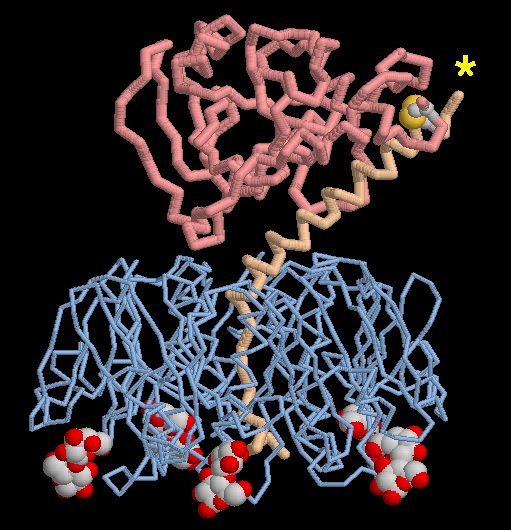
PDBエントリー 1ltt は大腸菌のエンテロトキシンがどのようにして腸内の標的細胞を見つけるのかを示している。この構造には、5分子のラクトース(lactose、上図下方に中が詰まった球で示された分子)が含まれており、これが毒素の標的結合部位と結合している。細胞表面にある炭水化物鎖は、毒素が細胞表面にくっつく時このラクトースと同じ場所に結合する。またこの構造では、毒性部位がどのようにして活性化されるのかも見ることができる。活性化に関わる部位は、標的結合部位への鎖をつなぎ止める長く伸びた部分(黄褐色)で構成されている。毒素が活性化される時、これらの部分をつないでいる小さな環状領域 (星印で示した部分)は切り取られジスルフィド結合(disulfide linkage)が壊されて、毒性部分(ピンク色)が細胞中に放出される必要がある。なお上にに示した構造では、この小さな環状領域は決まった立体構造をとっていない(disordered)ので、鎖は既に壊されているように見えている。
FASTA検索によるコレラ毒素関連エントリーの一覧はこちら。
コレラ毒素についてさらに知りたい方へ
以下の参考文献もご参照ください。
- 1995 The three-dimensional crystal structure of cholera toxin. Journal of Molecular Biology 251 563-573
- 1992 Lactose binding to heat-labile enterotoxin revealed by X-ray crystallography. Nature 355 561-564
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









