70: 人工設計タンパク質(Designer Proteins)
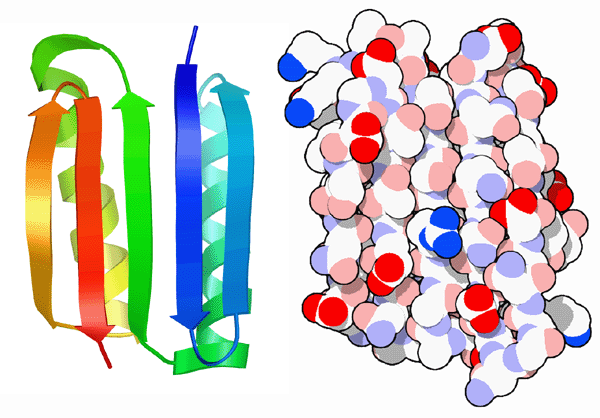
タンパク質について学び、どのように働くのかを知れば知るほど、その知識を利用し自分でいじくってみたくなるものである。1980年代の初めより、科学者たちはこれまでにタンパク質の構造と機能に関して分かってきたことを既存タンパク質の再設計に利用してきた。そして更に最近になって、全く新たなタンパク質の設計にも利用されるようになった。
タンパク質の設計
科学者たちは新規タンパク質の探究を始めるとすぐに、タンパク質が今まで見てきた以上に複雑であることに気づいた。それぞれ固有の化学的性質を持った様々な種類のアミノ酸は協同してタンパク質を折りたたみ、コンパクトで安定した構造にしている。ロイシン(leucine)やフェニルアラニン(phenylalanine)のように炭素が豊富なアミノ酸の集まりは通常タンパク質内部に置かれる。これらのアミノ酸は全て協同しタンパク質の構造をしっかり固定するために選ばれたものである。一方、リジン(lysine)やアスパラギン酸(aspartic acid)のように電荷を持ったアミノ酸はタンパク質の表面に分布していることが多く、タンパク質が水に溶けられるようにしている。セリン(serine)やアスパラギン(asparagine)のように水素結合を作るアミノ酸はタンパク質配列上で離れた場所に同士を結びつける重要な場所に点在している。最後に、グリシン(glycine)やプロリン(proline)のように変わったアミノ酸が、鎖を適切な方向へと向け直すために追加される。
負の設計
この都合のよい力の組み合わせによってタンパク質鎖は安定な状態に留まる。しかしこれはタンパク質設計の第一段階に過ぎない。うまく折りたたまれるタンパク質を設計するには、タンパク質が持つ安定な状態がたった1つしかないことも確かめる必要がある。もしそのタンパク質に他の折りたたみ様式があるなら、目的とする構造と競合して新たなタンパク質の構築に失敗するだろう。だから、安定なタンパク質構造を設計するだけでは不十分で、他のあらゆる配置が不安定になるよう設計することも必要なのである。
スタートラインからのタンパク質
何十年にもわたるタンパク質構造研究の積み重ねにより、米国シアトル(Seattle)のフレッド・ハッチンソンがん研究センター(Fred Hutchinson Cancer Research Center)とワシントン大学(University of Washington)の研究者たちは、これら正負の設計要素の重み付けにより完全に新しいタンパク質を作ることに成功した。彼らは、上図左に示すように、今まで自然界で見たことのない折りたたみ構造で始めた。そして、計算的方法を用いてこの折りたたみ構造に適当なアミノ酸配列を設計した。彼らがTop7と呼ぶこのタンパク質を作った時、確かにPDBエントリー 1qysで見ることができるように折りたたまれて設計通りの構造をとっていたのである。
驚くべきαらせん
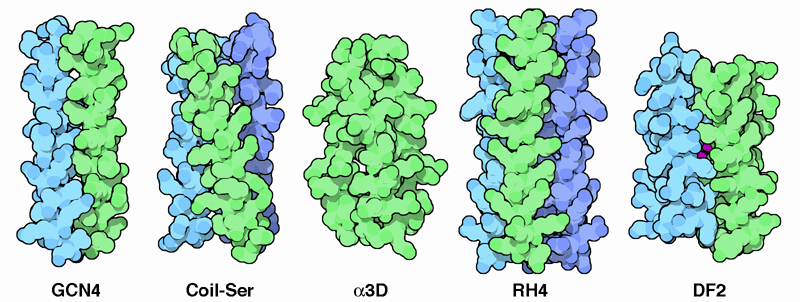
よくあるタンパク質設計の方法は、天然のタンパク質から始めて、それに変更を加えるというものである。多くのグループはαらせん(alpha helix)でできている特に安定な構造に注目してきた。GCN4タンパク質は酵母(yeast)の転写活性化因子(transcriptional activator)で、ロイシンジッパー(leucine zipper)でつながった2つの鎖でできている。なおこのロイシンジッパーとは、片側にたくさんのロイシンを含んだαらせんでできている特別な配列である。ロイシンは合わさってジッパーが締められるようきっちり間隔を空け、2つのαらせんをくっつけている。その様子が上図左端(PDBエントリー 2zta)に示されている。最初にこのタンパク質から話すのは、多くのグループがこの原則に基づいて新しいタンパク質を設計しているからである。その右にあるコイルセリン(Coil-Ser、PDBエントリー 1cos)はαらせんを作る3つの短いタンパク質鎖でできており、それらが集まって強固な束を形成する。次のα3D(alpha3D、PDBエントリー 2a3dは1本の鎖で構成され、それが折りたたまれて短いループでつながれた3つのαらせんで構成される束となっている。RH4(PDBエントリー 1rh4)は、αらせんの束の特徴的なねじれを取り除くよう内部のアミノ酸を注意深く選択して人工的に設計されたものである。αらせんが他の構造とは異なる傾き方をしていることに注目して欲しい。最後に、右端に示すタンパク質DF2(PDBエントリー 1jmb)で金属結合部位を付加しているように、今これらの人工タンパク質に新たな機能を持たせる設計が行なわれている。
構造をみる
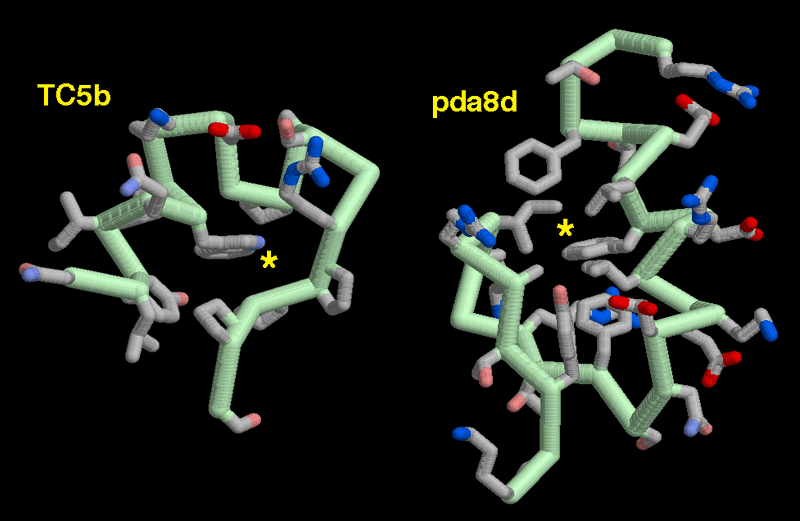
タンパク質設計が目指す目標の一つは、生物工学や医薬に用いる小さなタンパク質を作り出すことである。いくつかのグループは、天然のタンパク質から小さくて安定なドメインを取り出し、望んだ折りたたみ構造を安定化させるためにアミノ酸を再設計して小さなタンパク質を作り出している。ここでは2つの事例を示す。左に示すTC5b(PDBエントリー 1l2y)の基本的な折りたたみ構造はアメリカドクトカゲ(Gila monster)に見られるタンパク質から取り出されたもので、その両端を切り捨ててより安定性が増すよう再設計したものである。ど真ん中(星印で示した)にはプロリン(proline)に囲まれたトリプトファン(tryptophan)があり、それらが協同して構造を安定化させている。右に示すpda8d(PDBエントリー 1psv)やここには示していないFSD-1(PDBエントリー 1fsd)は、折りたたみ構造をジンクフィンガーからとり、折りたたみにもはや亜鉛が必要ないよう再設計されたものである。星印で示す中央部分には炭素が豊富なアミノ酸の塊があり、表面は電荷を持つ多くのアミノ酸で飾られている。
"人工設計タンパク質" のキーワードでPDBエントリーを検索した結果はこちら。
人工設計タンパク質についてさらに知りたい方へ
以下の参考文献もご参照ください。
- 1989 The de novo design of protein structures. Trends in Biochemical Sciences 14 304-309
- 1999 De novo design and structural characterization of proteins and metalloproteins. Annual Review of Biochemistry 68 779-819
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









