294: 注射体(Injectisome)
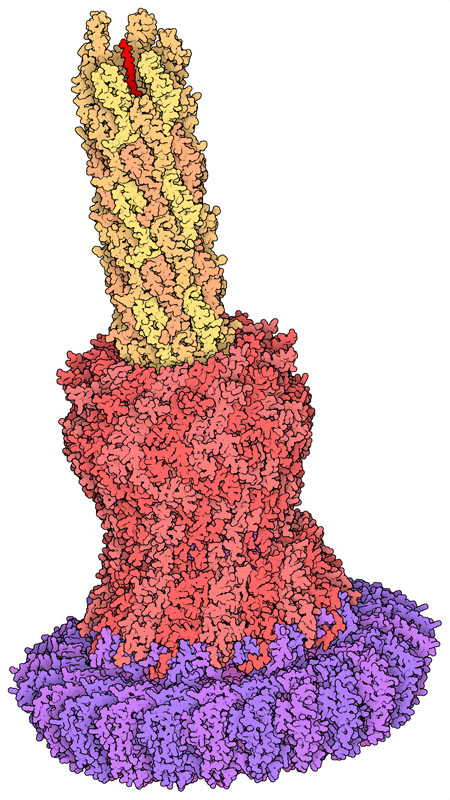
我们与许多细菌共生,我们与它们的互动通常是友好的。环境中的细菌会分解废物和死去的动植物。我们体内的细菌可以帮助我们处理所吃的食物,为我们提供所需的营养。不过,有时也会有不那么友好的互动。例如,沙门氏菌(Salmonella bacteria)会侵入我们的细胞并在内部繁殖,从而引发伤寒(typhoid fever)等危及生命的疾病。作为其致病策略的一部分,这些细菌利用名为注射体(injectisome)的针状分子注射数十种不同的效应蛋白。这些注入的蛋白质会使细胞防御失活,并改写细胞的新陈代谢,以帮助细菌在细胞内生长。
注射效应器
PDB 条目 7ah9包含 注射体沙门氏菌注射体的中心针状部分,其针头中间有一个孔,孔的大小刚好可以容纳一条未折叠的蛋白质链。一个分子门控制着效应蛋白通过针头,下面的交互式可操作图像详细显示了这个分子门。该结构还包含几个大的环形蛋白,它们将针头固定在细菌细胞壁上,使细菌能够将多个针头放置在它试图感染的细胞上。
完整的 注射体还包含一个位于细菌内部的大型分拣平台,此平台的结构没有包含在这个PDB条目中。该平台只选择适当的效应蛋白,并控制它们的注射顺序。它们的分泌过程分为三个阶段。首先,分泌 注射体本身,以产生针头等成分。其次,分泌一组蛋白质,制造穿透受感染细胞膜的转位子(translocon)。最后,注射体与这种转位子结合,将剩余的效应蛋白注入受感染细胞的细胞质中。
冻结活动
注射体的结构是通过冷冻电子显微镜确定的,其中含有效应蛋白SptP,这种酶可以去除细胞蛋白质中酪氨酸的磷酸盐,还能使几种受 GTP 调节的蛋白质失活。在观察蛋白质的运输过程中需要一些巧妙的方法。这是因为效应蛋白通过针头的时间通常不到一秒钟。具体来说,我们在 SptP 的末端添加了 绿色荧光蛋白(green fluorescent protein、GFP)。注射体无法解开 GFP的折叠,因此起到了钳子的作用,使其无法通过针孔,从而可以缓慢地捕获和研究复合物。
有效的效应器
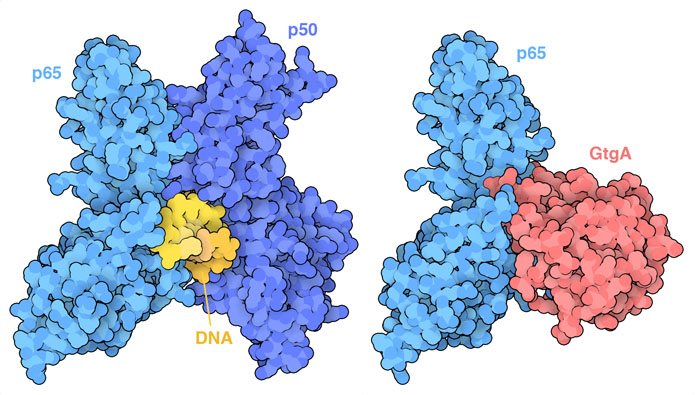
沙门氏菌会注入数十种不同的效应蛋白。其中许多会添加或去除磷酸盐、核糖基团和其他化学修饰,从而阻止细胞蛋白质发挥作用。另一组效应蛋白会将关键的细胞蛋白质送往 泛素化系统(ubiquitination system)进行处理。图中所示的效应蛋白GtgA是一种蛋白酶,它能裂解特定的转录因子p65(PDB条目6ggr),该转录因子是NF-κB信号通路的一部分,图中所示的 NF-κB 复合物是p65和p50(PDB 条目 1le5)与 DNA 结合的异二聚体。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
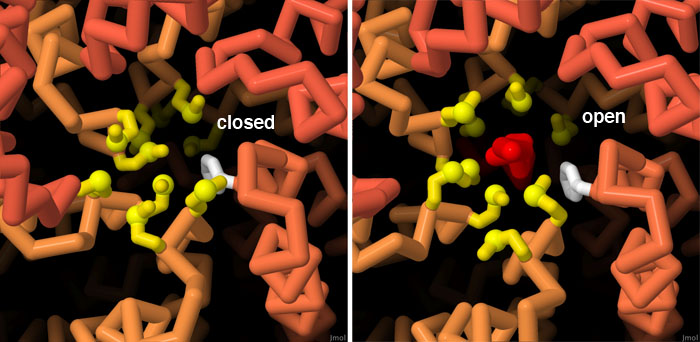
分泌针的入口受到蛋氨酸门(methionine gate)的保护,如 PDB 6pep所示,当分泌针不使用时,蛋氨酸群(黄色)得到单个苯丙氨酸(白色)的帮助,形成一道防水屏障。之后,一旦确定了要注入细胞的效应蛋白,蛋氨酸就会顺利分离,让细蛋白链(红色)通过,如 PDB 7ah9所示。点击屏幕下方的按钮,切换到交互式可操作图像,更详细地查看这两种结构。
进一步的讨论议题
- 搜索 "沙门氏菌 效应蛋白"(Salmonella effector),查看由注射体运输的该效应蛋白和其他效应蛋白的结构。
- 针状复合体包含几个对称的环状结构,由一种蛋白质的多个拷贝组成。
参考文献
- 2023 Speaking the host language: how Salmonella effector proteins manipulate the host. Microbiology 169 001342
- 7ah9 2021 Substrate-engaged type III secretion system structures reveal gating mechanism for unfolded protein translocation. Nat Commun 12 1546
- 6pep 2019 T3S injectisome needle complex structures in four distinct states reveal the basis of membrane coupling and assembly. Nat Microbiol 4 2010-2019
- 6ggr 2018 Structure-function analyses of the bacterial zinc metalloprotease effector protein GtgA uncover key residues required for deactivating NF-kappa B. J Biol Chem 293 15316-15329
- 1le5 2002 The X-ray crystal structure of the NF-kB p50/p65 heterodimer bound to the Interferon beta-kB site. J Biol Chem 277 24694-24700
 生物大分子学习的教育门户
生物大分子学习的教育门户 









