293: CFTR和囊肿性纤维化(CFTR and Cystic Fibrosis)
呼吸系统内壁的细胞需要管理离子和水在膜上的流动,以确保作为保护膜的粘液处于正确的浓度。CFTR(cystic fibrosis transmembrane conductance regulator,囊性纤维化跨膜传导调节器)在这种调节中发挥着重要作用:它允许带负电荷的离子(如氯离子和碳酸氢根离子)通过并根据需要打开或关闭,以调节气道环境。一旦这种功能被破坏,后果将不堪设想。囊肿性纤维化(cystic fibrosis)是一种由 CFTR 基因缺陷引起的遗传病;CFTR 功能失调会导致粘液变稠,导致气道阻塞和慢性肺部感染,危及生命。
打开和关闭
CFTR 与许多细胞表面转运体相似,如 细菌的多药耐药蛋白(bacterial multidrug resistance transporter)和我们的 P-糖蛋白(P-glycoprotein)。这些转运体的结构很有特点,一个跨膜区形成一个孔,细胞内侧有两个 ATP 结合域来调节孔的开闭。另一方面,CFTR 与其他转运体的不同之处在于,它被 PKA(环腺苷酸依赖蛋白激酶、cAMP-dependent protein kinase)磷酸化,还包含一个长的无序环,可调节其活性。在这些蛋白质中,CFTR 也是独一无二的,因为它起着离子通道的作用,打开时允许离子自由通过,而其余的都是专门将分子逐个运送过膜的转运蛋白。
功能增强
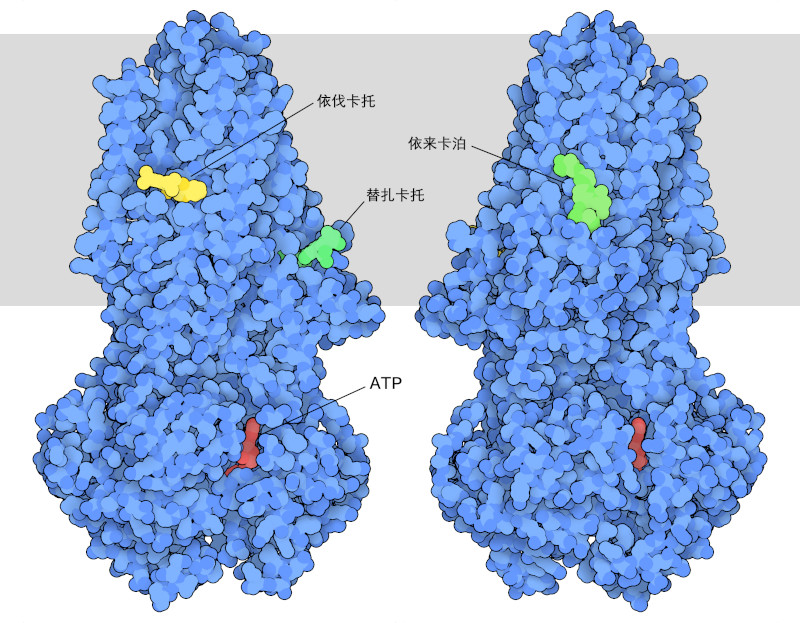
对 CFTR 结构和功能的了解促进了治疗囊性纤维化药物的发现。PDB ID 8eiq包含三种药物,它们通常被联合用于治疗最常见的 CFTR 变体患者。这些药物的作用方式与普通药物不同:它们不是抑制 CFTR 的作用,而是增强它的作用;CFTR 第 508 位上一个氨基酸(苯丙氨酸)的缺失使蛋白质不稳定,并导致一系列问题。首先,当 CFTR 在肺细胞中合成时,它们会感觉到问题存在,并破坏大部分蛋白质。因此,这些细胞表面的变异 CFTR 会减少。此外,不稳定的蛋白质作为离子通过的孔的作用也会降低。这种药物可以改善这两个问题。依伐卡托(ivacaftor)与形成孔的区域结合,提高了孔的稳定性和有效性。另一方面,依来卡泊(elexacaftor)和替扎卡托(tezacaftor)有助于在构建过程中稳定蛋白质,使更多的蛋白质出现在细胞表面。
新的治疗目标
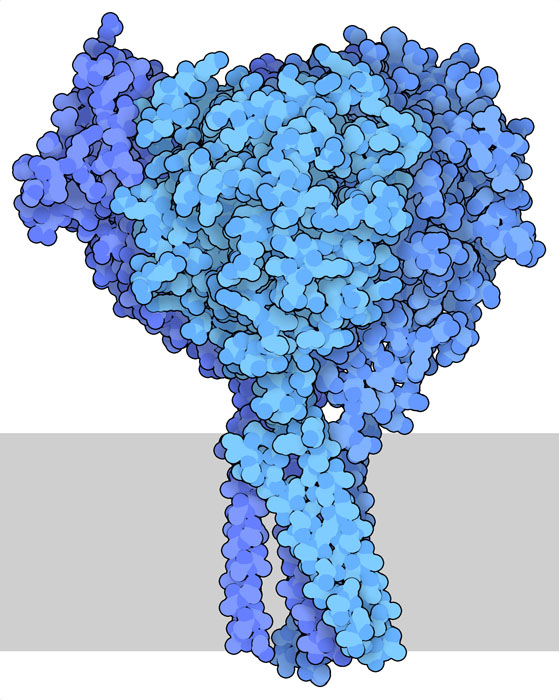
CFTR 并非管理肺气道液体平衡的唯一蛋白质。人们还在研究其他蛋白质,希望找到治疗囊性纤维化的新方法。上皮钠通道(epithelial sodium channel,PDB ID 6bqn)就是一个例子。顾名思义,它负责管理钠离子在细胞膜上的流动。
探索结构
要切换到有互动控制的页面,请点击图表下面的按钮。如果加载没有开始,请尝试点击图表。
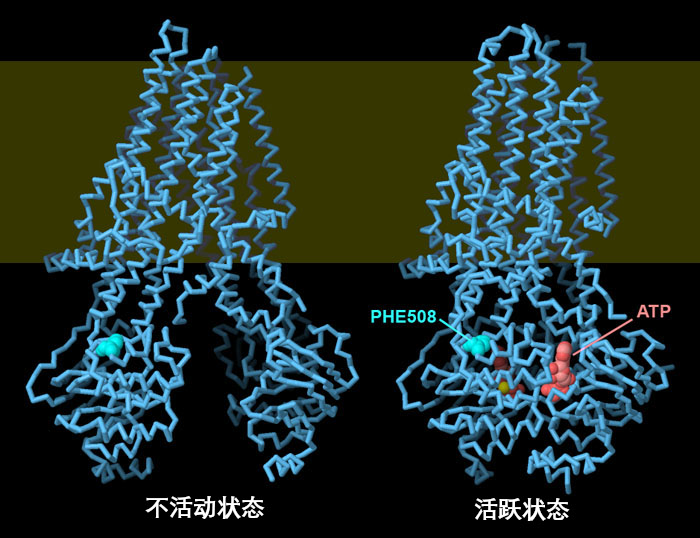
从 PDB IDs 5uak和 6msm的结构可以看出,CFTR 在激活时会发生重大的结构变化。在非激活状态下,两个 ATP 结合域分离,离子通道关闭;当 ATP(红色)结合时,两个 ATP 结合域连接,通道打开。苯丙氨酸 508 显示为亮蓝绿色。请注意该氨基酸如何稳定跨膜部分和其中一个 ATP 结合域之间的连接。点击图片下方的按钮,切换到交互式可操作图片,更详细地查看这些结构。
进一步的讨论议题
- CFTR 中存在调控域,但其中大部分没有确定的结构,在原子结构中也观察不到。通过计算获得的结构模型可以看出它们有多大。
参考文献
- 8eiq 2022 Molecular structures reveal synergistic rescue of Delta 508 CFTR by Trikafta modulators. Science 378 284-290
- 2019 Structure, gating, and regulation of the CFTR anion channel. Physiol Rev 99 707-738
- 6bqn 2018 Structure of the human epithelial sodium channel by cryo-electron microscopy. Elife 7 e39340
- 6msm 2018 Molecular structure of the ATP-bound, phosphorylated human CFTR. Proc Natl Acad Sci U S A 115 12757-12762
- 5uak 2017 Molecular Structure of the Human CFTR Ion Channel. Cell 169 85-95.e8
 生物大分子学习的教育门户
生物大分子学习的教育门户 









