293: CFTRと嚢胞性線維症(CFTR and Cystic Fibrosis)
私たちの呼吸器系を覆う細胞は、保護膜の役割をしている粘液が適切な濃度となるように、膜を横切るイオンや水の流れを管理する必要がある。CFTR(cystic fibrosis transmembrane conductance regulator、嚢胞性線維症膜貫通伝導制御因子)は、この調節における重要な役割を担っている。CFTRは塩化物イオンや重炭酸イオンのような負電荷を帯びたイオンを通過させ、また必要に応じ開閉して気道の環境を制御する。この機能が阻害されると、悲惨な結果を招く。嚢胞性線維症(cystic fibrosis)は、CFTR遺伝子の欠陥によって引き起こされる遺伝病である。CFTRの不適切な機能により粘液が濃くなり、生命を脅かす気道閉塞や慢性肺感染症を引き起こす。
開けたり閉めたり
CFTRは、細菌の多剤耐性輸送体(bacterial multidrug resistance transporter)や我々のP-糖タンパク質(P-glycoprotein)など、多くの細胞表面輸送体と似ている。これらの輸送体は特徴的な構造を持っていて、膜横断領域が穴を形成し、細胞内側にある2つのATP結合ドメインがその開閉を制御している。一方CFTR は、これらの他の輸送体とは異なり、PKA(環状AMP依存性タンパク質リン酸化酵素、cAMP-dependent protein kinase)によってリン酸化され、その活性を制御する長くて定まった構造をとらないループ部分も含んでいる。CFTRはまた、イオンチャネルとして働き、開いている時にはイオンを自由に通過させるという点でも、これらタンパク質の中において独特である。他のタンパク質はすべて、分子を一度に一つずつ膜を通過させる輸送体である。
機能強化
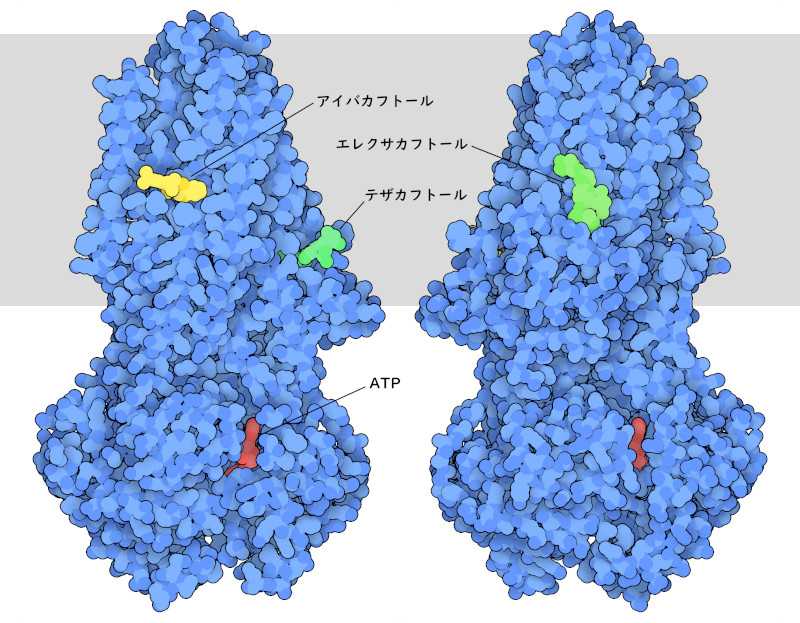
CFTRの構造と機能に関する知見により、嚢胞性線維症を治療する薬の発見が促進された。PDB ID 8eiqには、この病気を引き起こす最も一般的なCFTR変異体を持つ患者を治療するために、しばしば併用される3つの薬剤が含まれている。これらの薬剤は一般的な薬剤とは異なる方法で作用する。CFTRの作用を阻害するのではなく、その機能を増強するのである。CFTRの508番目にあるアミノ酸のフェニルアラニンが1つ欠失すると、タンパク質が不安定になり、多くの問題を引き起こす。まず、肺細胞でCFTRが合成されるとき、肺細胞は問題を感知し、タンパク質の大部分を破壊する。そのため、これらの細胞の表面には変異したCFTRが少なくなる。また、不安定化したタンパク質はイオンを通す穴としての効果が低い。薬はこれら2つの問題を改善する。アイバカフトール(ivacaftor)は穴を形成する領域に結合し、穴の安定性と有効性を高める。一方、エレクサカフトール(elexacaftor)とテザカフトール(tezacaftor)は、構築中のタンパク質が安定化するのを助け、より多くのタンパク質が細胞表面に存在するようにする。
新たな治療対象
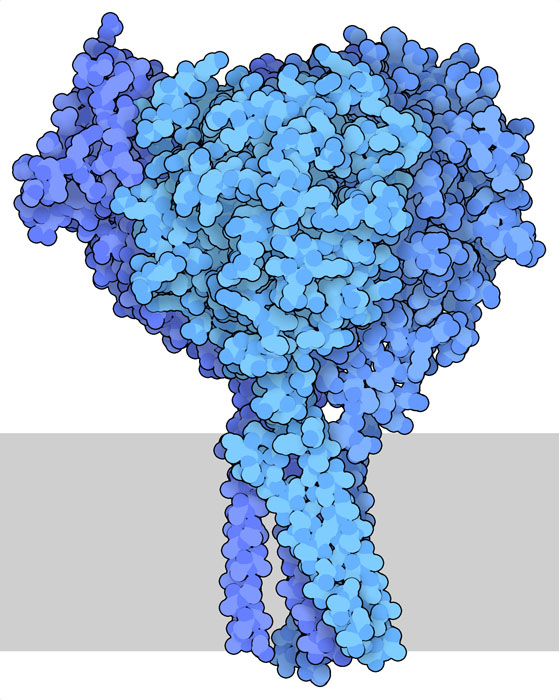
肺気道の体液バランスを管理するタンパク質はCFTRだけではない。嚢胞性線維症を治療する新たな方法が見つかることを期待して、他のタンパク質の研究も行われている。上皮性ナトリウムチャネル(epithelial sodium channel、PDB ID 6bqn)はその一例である。その名の通り、細胞膜を横切るナトリウムイオンの流れを管理している。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
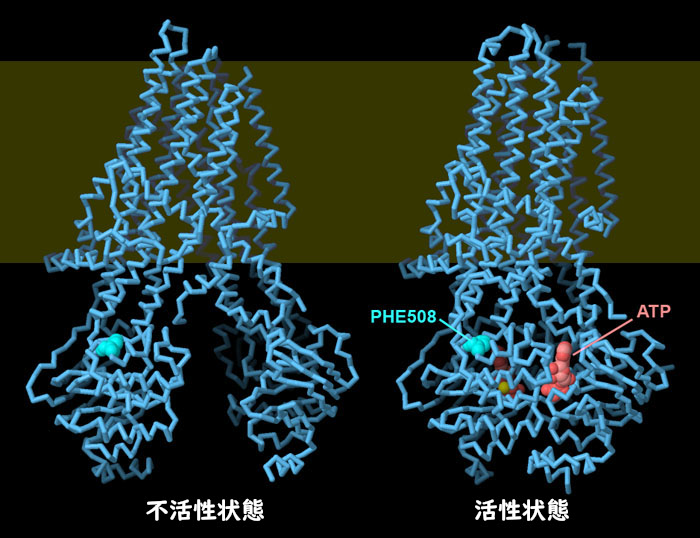
PDB ID 5uakと6msmの構造を見るとわかるように、CFTRは活性化すると大きな構造変化を起こす。不活性型のとき、2つのATP結合ドメインは離れており、イオンチャネルは閉じている。ATP(赤色)が結合すると、2つのATP結合ドメインがくっついて、チャネルが開く。フェニルアラニン508は明るい青緑色で示す。このアミノ酸が、膜貫通部分とATP結合ドメインの1つとの接合部分をどのように安定化させているかに注目して欲しい。画像の下にあるボタンをクリックして対話的操作のできる画像に切り替え、これらの構造をより詳しく調べてみて欲しい。
理解を深めるためのトピックス
- CFTRの中には調節ドメインがあるが、その大部分は構造が定まっておらず、原子構造では観測されていない。計算で得られた構造モデルを見ると、それがどれぐらいの大きさなのかの印象をつかむことができる。
参考文献
- 8eiq 2022 Molecular structures reveal synergistic rescue of Delta 508 CFTR by Trikafta modulators. Science 378 284-290
- 2019 Structure, gating, and regulation of the CFTR anion channel. Physiol Rev 99 707-738
- 6bqn 2018 Structure of the human epithelial sodium channel by cryo-electron microscopy. Elife 7 e39340
- 6msm 2018 Molecular structure of the ATP-bound, phosphorylated human CFTR. Proc Natl Acad Sci U S A 115 12757-12762
- 5uak 2017 Molecular Structure of the Human CFTR Ion Channel. Cell 169 85-95.e8
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









