281: セルラーゼとバイオエネルギー(Cellulases and Bioenergy)
石油に由来する燃料は減ってきていて、気候変動の主な原因ともなっている。そこでバイオエネルギーの研究者たちは自然界に目を向け、人類に提供するよりクリーンで再生可能な燃料を探している。エタノール(ethanol)は、燃料として、あるいは持続可能な航空燃料を製造するための中間体として魅力的な解決策の一つになるのではないかと考えられている。アルコール飲料は有史以前から糖を発酵して製造されていたが、現在これと同じ技術を使って燃料となるエタノールがつくられている。現在、糖のほとんどはトウモロコシとサトウキビでまかなわれているが、このやり方は食糧生産に適した土地をエネルギー用に転用してしまうことになり、また作物を生産するときに多くエネルギーを消費するので理想的とは言えない。そこで、スイッチグラス、ポプラ、トウモロコシの茎など、より丈夫で食用にならない作物のセルロース(cellulose)をエタノールに変換する方法を探す努力が続けられている。
セルロースの分解
セルロースはブドウ糖(glucose)からできているが、ブドウ糖同士が強固に結合し安定したポリマーとなっている。セルロース合成酵素(cellulose synthase)がセルロースの鎖を何本も積み重ね、さらに丈夫な繊維にすることで、セルロースは作られている。そのため、セルロースを発酵しエタノールを工業的に製造する場合、あらかじめセルロースの鎖を分離し、小さな糖へと切断しておく必要がある。通常、植物原料は、化学薬品や「水蒸気爆発」などの強力な過程を使って前処理しておき、植物の細胞壁を破壊することで酵素がセルロース繊維に作用できるようにする。次に、セルラーゼ酵素群を組み合わせて作用させることにより、セルロース繊維を個々の糖へと分解していく。このセルラーゼ酵素の原料となるのが、トリコデルマ・リーゼイ(Trichoderma reesei、別名ハイポクリア・ジェコリナ Hypocrea jecorina)という真菌である。これは第二次世界大戦中にソロモン諸島で発見された種で、綿生地に生えていたものである。現在では、バイオエタノール製造のほか、ストーンウォッシュジーンズのデニムを柔らかくするなどの作業にも広く利用されている。
セルラーゼの科学
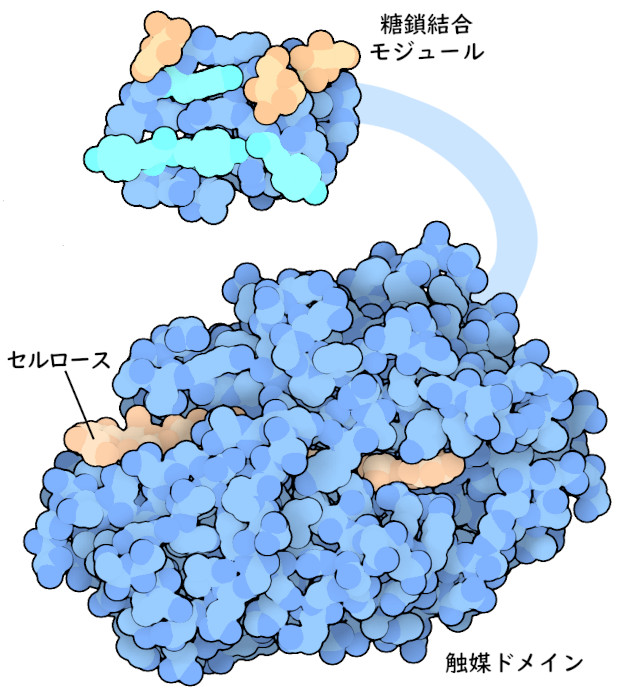
セルラーゼの中には、頑丈なセルロース繊維を分解するためのドメインを2つ持つものがある(ここに示すのはPDBエントリー7celと2mwkの構造)。一方のドメインにはセルロース鎖にぴったり合う長い溝があり、セルロース鎖はここに結合してブドウ糖分子間の結合が引っ張られ、切断するための触媒機構に向かって配置される。もう一方のドメインはセルロースに結合して、酵素が常に正しい位置にあるようにし、多くの切断反応を素早く連続して行うことができるようにしている。
セルラーゼのカクテル
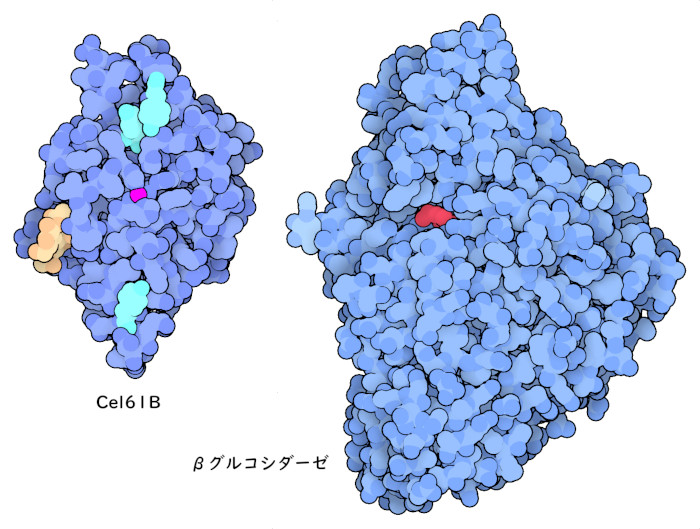
トリコデルマ・リーゼイのような菌類は、セルロース分解酵素の複雑な混合物を分泌し、それらが連携してセルロース繊維を攻撃する。ここでは2つの例を紹介するが、その他にも酵素の構造が多数PDBアーカイブで公開されている。エンドグルカナーゼ7(endoglucanase 7)として知られるCel61Bは、金属イオンを使って活性酸素を発生させ、セルロースを攻撃するという積極的な方法を使う(PDBエントリー2vtc)。Cel7Aのセルロース結合ドメインと同様に、Cel61Bにもいくつかのチロシンやグリコシル化した部位があって、セルロース繊維との接着を助けている。β-グルコシダーゼ(beta-glucosidase、PDBエントリー3zyz)は、反応過程の後半で、セルロースの短い断片を個々のブドウ糖へと切断する働きをする。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
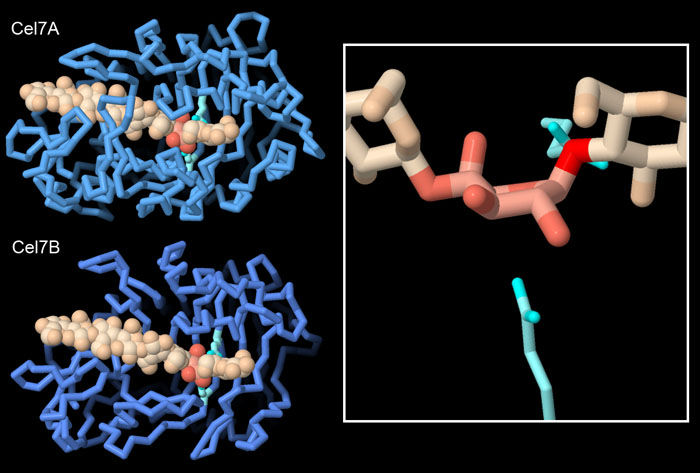
セルラーゼは、その機能を効率化するために多くの分子的技法を使っている。上述の通り、セルラーゼは、セルロース繊維の表面に結合するドメインや表面を持っていることが多い。また、セルロースと結合する部位の形も、特化した機能を果たせるように調整されている。Cel7A(PDBエントリー4c4c)では、いくつかのループがセルロースポリマーを取り囲み、一端には活性部位があるトンネルをつくっている。Cel7Aはこの構造を使い、セルロース繊維の末端から小さな2糖の断片を切り取る。一方、Cel7B(エンドグルコナーゼEG-1、endoglucanase EG-1、PDBエントリー1eg1)はこれらのループがなく、セルロース鎖のどの位置にでも結合できるオープンな溝を持っているため、鎖の途中でセルロースを切断することができる。図右側の拡大図には、別の分子的技法を示している。これらの酵素は、一方の糖が持つ環(ここでは薄い赤茶色で示す)を安定度の低い配置へと歪ませることがよくある。この歪みは、2つのグルタミン酸(水色)によって触媒される切断反応において、単糖同士の間をつないでいる酸素(赤色)を活性化するのに役立つ。図の下のボタンをクリックして対話的操作のできる画像に切り替え、これらの構造をより詳しく見てみて欲しい。なお、PDBエントリー4c4cのセルロース鎖は、両方のタンパク質で表示している。
理解を深めるためのトピックス
- PDBjの検索やRCSB PDBのAnnotation Browserを使って他のセルラーゼの構造を見つけることができます。3.2.1.4(セルラーゼ cellulases: PDBj / RCSB PDB)や3.2.1.91(セルロース 1,4-β-セロビオシダーゼ cellulose 1,4-beta-cellobiosidases:PDBj / RCSB PDB)で検索してみてください.
- Cel7Aが持つ2つのドメインをつなぐ柔軟なループを見るには、AlphaFold2によって予測された構造AF_AFP62694F1を見てみてください。リンカーの末端には柔軟性を高めるためのプロリンがいくつかあり、グリコシル化されている可能性のあるスレオニンやセリンが多数あることに注目してください。
- セルラーゼの科学に関するちょっとした注意事項:セルラーゼには多くの種類があり、科学者は物事を分類して名前をつけるのが大好きです。そのため、同じ酵素にいくつもの違う名前がついていることがよくあります。例えば、Cel7Aという短い名前は、セルラーゼ酵素群における大枠の分類に基づいた名前で、1,4-β-D-グルカンセロビオヒドロラーゼI(1,4-beta-D-glucan cellobiohydrolase I)やセルロース1,4-βセルビオシダーゼ(cellulose 1,4-beta cellobiosidase)、エキソグルカナーゼI(exoglucanase I)などの長い名前は、セルロース鎖の末端から2糖単位で切断するという作用を示しています。
参考文献
- 2020 Current state-of-the-art in ethanol production from lignocellulosic feedstocks. Microbiol Res 240 126534
- 2mwk 2015 O-glycosylation effects on family 1 carbohydrate-binding module solution structures. FEBS J 282 4341-4356
- 2015 Fungal cellulases. Chem Rev 115 1308-1448
- 3zyz 2014 Biochemical Characterization and Crystal Structures of a Fungal Family 3 Beta-Glucosidase, Cel3A from Hypocrea Jecorina. J Biol Chem 289 31624-31637
- 4c4c 2014 The Mechanism of Cellulose Hydrolysis by a Two-Step, Retaining Cellobiohydrolase Elucidated by Structural and Transition Path Sampling Studies. J Am Chem Soc 136 321-329
- 2vtc 2008 The First Structure of a Glycoside Hydrolase Family 61 Member, Cel61B from the Hypocrea Jecorina, at 1.6 A Resolution. J Mol Biol 383 144-154
- 1998 High-resolution crystal structures reveal how a cellulose chain is bound in the 50 A long tunnel of cellobiohydrolase I from Trichoderma reesei. J Mol Biol 275 309-325
- 1eg1 1997 The crystal structure of the catalytic core domain of endoglucanase I from Trichoderma reesei at 3.6 A resolution, and a comparison with related enzymes. J Mol Biol 272 383-397
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









