265: ゴルジ体カゼインキナーゼ(Golgi Casein Kinase)
初期に発見された生体分子の多くは、入手や精製が容易なタンパク質を用いたものだった。初期に決定されたタンパク質の構造は、例えば、大量に得られるクジラの筋肉に由来するミオグロビン(myoglobin)や、血液から容易に精製できるヘモグロビン(hemoglobin)であった。1800年代後半には、牛乳で最も豊富に含まれているタンパク質のカゼイン(casein)はリンを含むことが分かった。その後の研究で、このリンはタンパク質に含まれるアミノ酸のセリンに付加されたリン酸基の一部であることが明らかになった。そして、多くのリンタンパク質が見つかり、タンパク質にリン酸基を付加するキナーゼ(kinase)やリン酸基を除去するフォスファターゼ(phosphatase)も多数発見された。
どこにでもあるキナーゼ
PDBアーカイブで「カゼインキナーゼ」(casein kinase)を検索すると、たくさんの構造が見つかるだろう。しかしこのキナーゼという名前はやや不適切である。カゼインをリン酸化することで発見されたため「カゼインキナーゼ」と呼ばれているのだが、ほとんどのカゼインキナーゼにとってリン酸化する機能は主な生物学的機能ではない。むしろ、細胞の細胞質における信号伝達で不可欠な役割を果たしているので、ゴルジ体でつくられ分泌されるカゼインと接することは通常ない。実際、牛乳のカゼインをリン酸化するキナーゼが発見されたのは2012年になってからである。
本物のカゼインキナーゼ
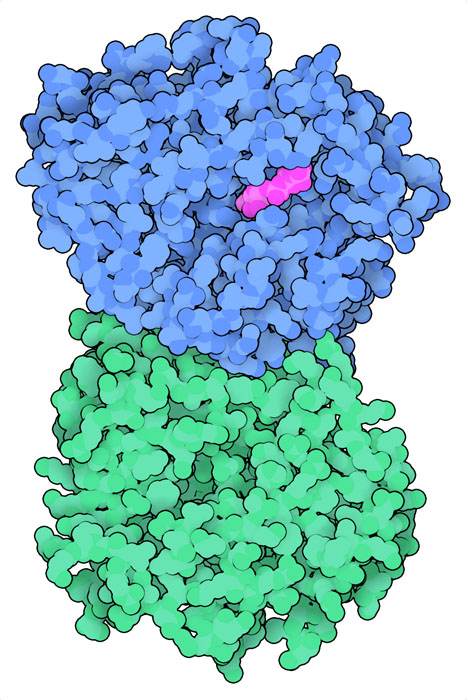
ゴルジ体カゼインキナーゼ(golgi casein kinase、ここに示すのはPDBエントリー5yh2の構造)はカゼインやその他さまざまな分泌タンパク質にリン酸を付加する。これは、似た2種類のタンパク質が複合体をつくっているときに最も活性が高い。Fam20Cが触媒サブユニットで、カゼインに結合しリン酸をATPからタンパク質へと移す。Fam20Aは触媒としての活性はないが、Fam20Cに結合して活性をさらに高める。このため、構造的には他のキナーゼと似ているが酵素ではないことから、偽キナーゼ(pseudokinase)と呼ばれることがよくある。さらに、3つ目のタンパク質Fam20Bは、これら2つのタンパク質と似ているが、糖にリン酸を付加する。
牛乳に含まれるカゼイン

乳はタンパク質、脂肪、栄養素を含む複雑な混合物で、成長期の乳児が必要とするすべてのものを提供する。牛乳に含まれるタンパク質のほとんどはカゼインだが、ヒトの乳に含まれるカゼインの量はそれよりも少ない。カゼイン鎖はほとんど決まった構造をとっていない(そのため、PDBアーカイブには今のところカゼインのエントリーはない)。そして、牛乳の中で大きなミセル(micelle)に結合している。カゼイン分子には高度にリン酸化された領域があり、ミセル中にあってカルシウムとリン酸でできている小さなミネラルナノクラスターと結合している。残りの部分は疎水性で、互いにくっつき合っている。κカゼイン(kappa-casein)と呼ばれる特殊なカゼインはミセルの表面を覆っている。κカゼインの外側は負の電荷を帯び糖化されている。これはミセル全体を可溶化するのに役立っている。
牛乳とチーズ
よく知られた牛乳の特徴には、カゼインのミセル構造に起因するものがいくつかある。大きなミセルは、大きな脂肪球とともに光を散乱させ、それによって牛乳は不透明で白いものとなる。また、チーズの製造工程もミセルの構造に依存している。牛乳はレンネット(rennet)で処理されるが、これにはκカゼインの伸長部分を切り取る酵素が含まれている。切り取られたミセルはほとんど溶けず、凝集して凝乳(curd)となる。そして周囲にある乳タンパク質は液体の乳清(whey、ホエイ)をつくる。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
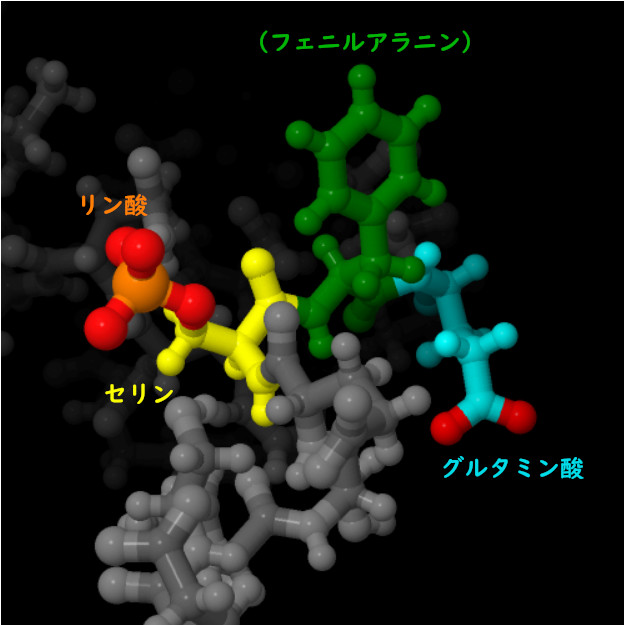
ゴルジ体カゼインキナーゼは、S-X-E(「S」はリン酸基を付加するセリン、「X」は何でもよい、「E」はグルタミン酸)という特徴的な配列パターン(モチーフ)を持つタンパク質に対しこの位置でリン酸基を付加する傾向がある。この酵素は既にリン酸化されたセリンが「E」の位置にある場合にもよく働く。PDBエントリー2lidには、この配列パターンにリン酸が付加された事例が含まれている。このタンパク質は、卵黄にみられ高度にリン酸化されたタンパク質ビテロゲニン(vitellogenin)である。ここに示す例は、スズメバチから得られたビテロゲニン類似物質である。 この構造をより詳しくみるため、図の下のボタンをクリックして対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- RCSB PDBのPairwise Structure Alignment Toolを使ってFam20C(PDBエントリー5yh2のB鎖)とFam20A(PDBエントリー5yh2のA鎖)の構造を比較してみてください。また、Fam20B(PDBエントリー5xooのA鎖)との比較もやってみてください。
- PDBにはリン酸化されたセリンアミノ酸を含むタンパク質の構造がたくさん登録されています。それらを見つけるには、PDBjのホスホセリン(SEP)ページで「関連するPDBエントリー」タブを表示するか、またはRCSB PDBのホスホセリン(SEP)ページで「is present in a polymer sequence」をクリックしてみてください。
参考文献
- 2021 The ABCs of the atypical Fam20 secretory pathway kinases. J Biol Chem 296 100267
- 2020 Composition, structure, and digestive dynamics of milk from different species. Front. Nutrition 7 577759
- 5yh2 2018 Structure and evolution of the Fam20 kinases. Nat Commun 9 1218-1218
- 2lid 2012 A vitellogenin polyserine cleavage site: highly disordered conformation protected from proteolysis by phosphorylation. J Exp Biol 215 1837-184
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









