266: 寡糖轉移酶(Oligosaccharyltransferase)
幾乎所有的活細胞都被一層複雜的碳水化合物(carbohydrate)包裹著。它們是由幾種類型的單醣以無數不同的方式連接在一起。這種碳水化合物塗層在細胞的生活中扮演許多重要角色。這種糖衣扮演著各種角色,對細胞生命很重要。例如,在一些結構中,碳水化合物是笨重的,形成一個保護罩,控制進入細胞表面。分泌蛋白,如血清蛋白,常常被糖基化(glycosylated),這增加了它們的可溶性和穩定性。醣類也有幾種不同的形狀和大小,每個生物體通常有自己的醣類群,具有不同的特徵。ABO血型是一個熟悉的例子。我們自己的細胞表面糖基化的個人變化,以及在醫療方面,如輸血,我們必須避免使用那些與我們自己的糖基化模式不同。
糖基化蛋白
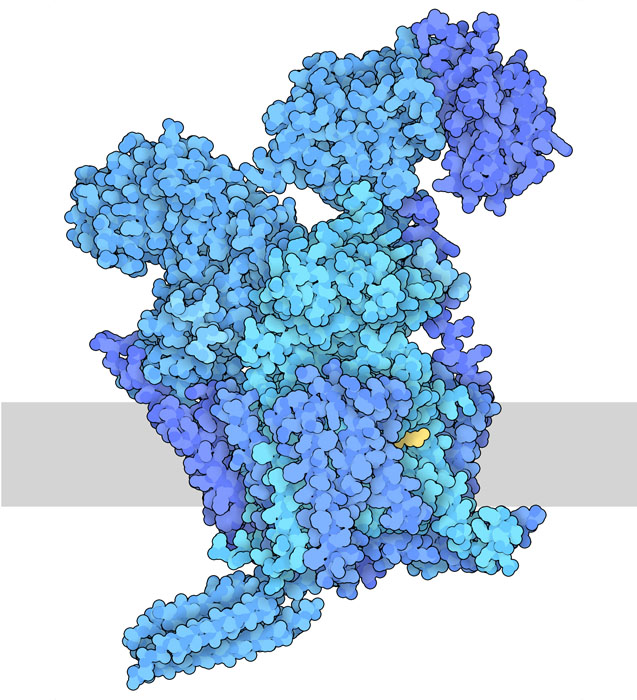
醣類最常透過兩種方法與蛋白質結合:透過與絲氨酸(serine)或蘇氨酸(threonine)的氧原子結合(O-糖基化,O-glycosylation)或與天冬胺(asparagine)的氮結合(N-糖基化,N-glycosylation)。 N-糖基化反應是由寡糖轉移酶(oligosaccharyltransferase)進行的。我們的細胞製造這種酵素的兩種類似形式~OST-A(這裡顯示的PDB條目6s7o)和OST-B(PDB條目6s7t,這裡沒有顯示)。首先,一組不同的酵素在一個由脂質製成的標尺上逐一建立醣類。第二,寡糖轉移酶,顧名思義,將糖鏈從脂質轉移到蛋白質上的天冬胺酸。在我們的細胞中,這種轉移發生在內質網中,糖鏈在內質網和高爾基體(Golgi 身體)中被其他酶進一步修改和排列。由此產生的糖蛋白要麼被運送到細胞表面,要麼被排出細胞外。
病毒和醣類
我們與病毒不斷地進行拔河,圍繞著糖基化的蛋白質進行鬥爭。然而,病毒已經進化到可以躲避這種保護。例如,流感病毒使用血凝素(hemagglutinin)分子來識別細胞表面的碳水化合物,並在感染期間使用它們。免疫系統也被捲入這場戰鬥。内在的免疫系统(intrinsic immune system)可以辨識病原體表面不熟悉的碳水化合物。但威脅生命的病毒,如人類免疫缺陷病毒(Human Immunodeficiency Virus,HIV)和SARS冠狀病毒2型。它們用類似人類的碳水化合物包裹自己,以幫助它們逃避我們的免疫系統。
行動中的OST-A
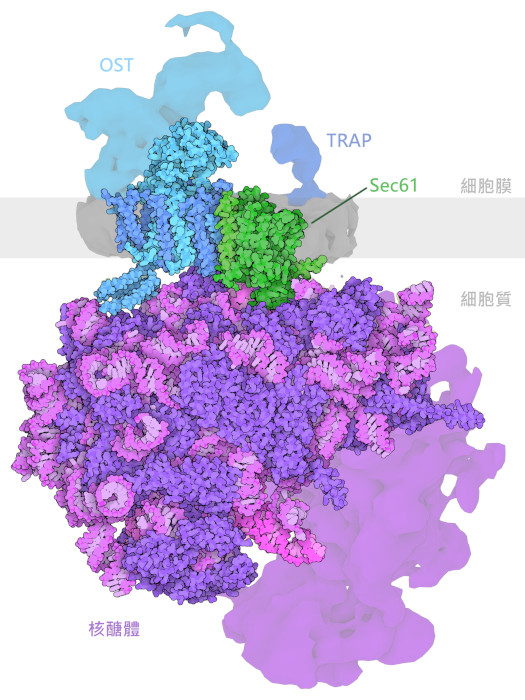
寡糖轉移酶A與蛋白質合成機器一起工作,在製造蛋白質時添加糖鏈。這裡顯示的結構(PDB條目6fti)代表了轉移反應後過程中的一個步驟。核糖体( ribosome)建構蛋白質鏈,透過蛋白質傳導通道Sec61將其運送到內質網。寡糖轉移酶在適當的天門冬胺酸位點為新的蛋白質鏈添加糖鏈。該酶可識別蛋白質序列中的一個特徵模式,並在天冬酰胺上添加一個糖鏈,其中糖鏈上的兩個後面氨基酸是絲氨酸或蘇氨酸,而不是旁邊的脯氨酸。
探索結構
若要切換到有互動控制的頁面,請點選圖表下方的按鈕。如果載入沒有開始,請嘗試點擊圖表。
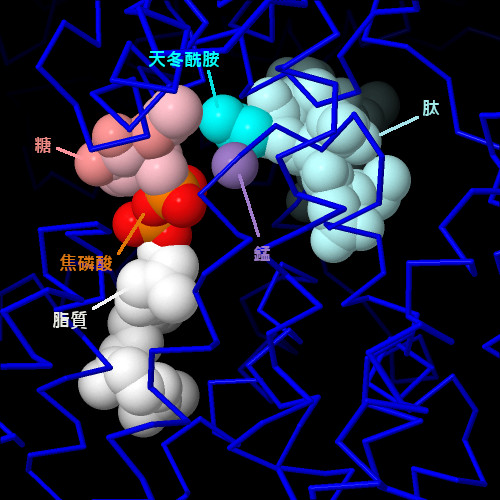
透過觀察一個更簡單的細菌寡糖轉移酶(PDB條目5ogl),我們可以看到碳水化合物轉移反應的細節。碳水化合物透過焦磷酸(pyrophosphate)附著在脂質上,使碳水化合物活化,進行化學反應。需要附近的二價金屬離子來結合分子並催化它們之間的反應。點擊圖片下方的按鈕,切換到可操作的互動圖片,以更詳細地查看這個結構。
進一步的討論議題
- 要找到N-糖基化的蛋白質,請使用RCSB PDB高級搜尋並選擇結構屬性->糖基化位置->N-糖基化。
- 要了解更多關於碳水化合物以及如何在PDB檔案中探索它們,請查看RCSB PDB PDB-101頁面探索PDB中的碳水化合物檔案。
參考文獻
- 6s7o 2019 Cryo-electron microscopy structures of human oligosaccharyltransferase complexes OST-A and OST-B. Science 366 1372-1375
- 6fti 2018 Structural basis for coupling protein transport and N-glycosylation at the mammalian endoplasmic reticulum. Science 360 215-219
- 6ogl 2017 Molecular basis of lipid-linked oligosaccharide recognition and processing by bacterial oligosaccharyltransferase. Nat Struct Mol Biol 24 1100-1106
- 2017 Biological roles of glycans. Glycobiology 27 3-49
- 2006 Glycosylation in cellular mechanisms of health and disease. Cell 126 855-867
 生物大分子學習的教育門戶
生物大分子學習的教育門戶 









