264: SARSコロナウイルス2型スパイク変異体(SARS-CoV-2 Spike Variants)
ウイルスは、ウイルス自身が不注意なやり方をしていることにより、進化の達人となっている。2つの観点から、ウイルス生物学は特にうまくいっていると言えるだろう。まず、ウイルスが細胞に感染して増殖する際、膨大な数のウイルスが生み出される。例えば、SARSコロナウイルス2型(SARS-CoV-2)による感染のピーク時には、感染者に10億から1000億個のウイルスが存在しているかもしれない。次に、複製するための分子機械はいい加減であることが多く、子孫に誤りが生じることがある。これが急速な進化にとって最適な組み合わせとなっている。感染の過程で複製がおこなわれるときにさまざまな変異ウイルスがつくられる。配列変異の大部分はウイルスに損傷を与えるか、または良くも悪くもなくほとんど中立的なものであるが、時折ウイルスの生活環である箇所における機能を強化する。このまれにしか現れない有利な変異体は、SARSコロナウイルス2型で何度も出現しており、現在進行しているSARSコロナウイルス2型大流行で新たな感染拡大を引き起こしている。
変異体を評価する
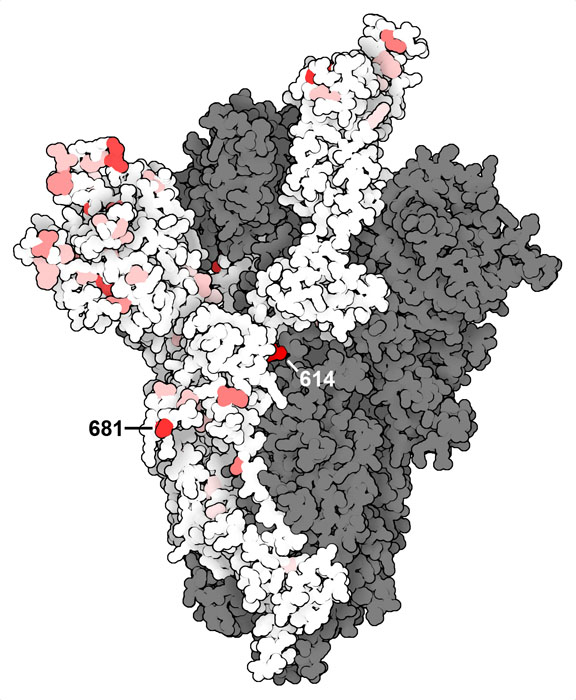
世界中の科学者がSARSコロナウイルス2型の進化を研究し、その能力を理解して将来の計画に役立てている。ここに示す図は、配列決定されGISAIDに登録された300万件以上のサンプルに基づいた、スパイクタンパク質の主な変異部位を示している。構造はPDBエントリー7kj2に基づくが、原子座標はSWISSMODELからとっている。なぜならPDBに登録されているデータにはいくつかの柔軟なループ領域の原子座標が含まれていないからである。また、この図ではタンパク質の変異を見やすくするため糖鎖修飾を示していない。だから、複数の糖鎖で覆われたタンパク質を想像する必要がある。
機能の改良
ご覧の通り、変異部位は三次元構造のあちこちに散らばっている。まだ各変異の働きが解明されたわけではないが、いくつかのよくある変異体については明らかになりつつある。(少なくとも現時点において)最もよく変異が起こっている箇所は、614番目のアミノ酸である。これは、後述するように、スパイクの上の部分の安定性を制御していると考えられている。この他でよく変異が起こるのは681番目のアミノ酸で、フューリン(furin)という細胞のプロテアーゼが鎖を2つに分断するときに切断する柔軟なループ領域中にある。上部(S1)は宿主細胞を認識し、下部(S2)は宿主融合とし細胞内に入るよう指示する。ウイルスは、この切断によって呼吸器細胞により感染しやすくなることが分かっている。
変異体の構造
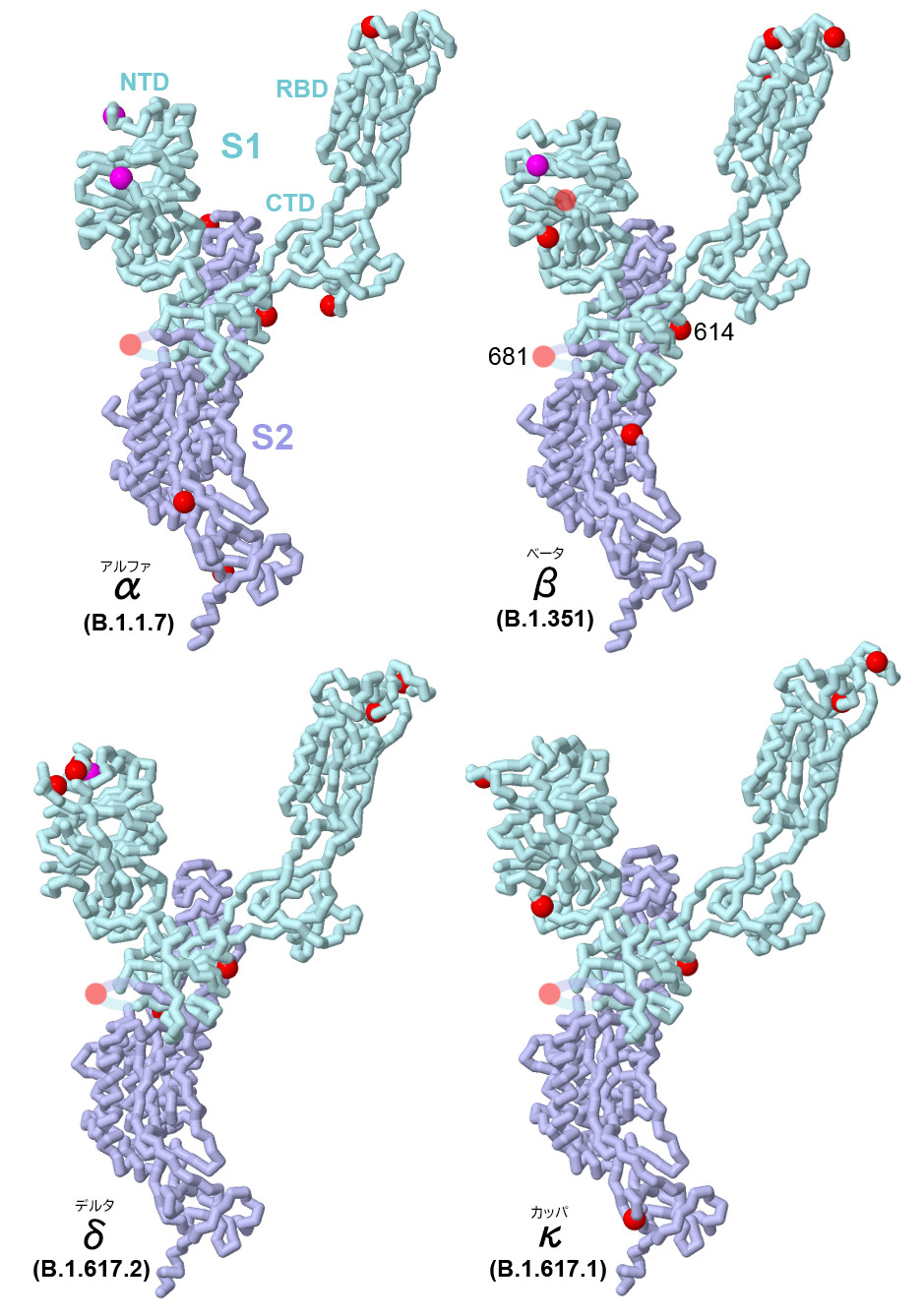
SARSコロナウイルス2型感染症(COVID-19)の大流行で、SARSコロナウイルス2型は世界中に広まり、また変異体はあちこちの国で偶然現れそこから急速に広まっていった。ここには最近見られる4種類の変異体の構造を示す(PDBエントリー7lwv、7lyo、7v7q、7v7e)。いずれも、アミノ酸が変化したり(赤色で示す部分)、鎖から除去されたり(赤紫色で示す部分)して複数箇所に変化が生じている。いずれも上述した2つの共通箇所だけでなく、構造全体のあちこちにある別の箇所も変化している。これらはウイルスにとってさまざまな方法で利をもたらす。受容体結合ドメイン(receptor-binding domain、RBD)とC末端ドメイン(C-terminal domain、CTD)の変異は細胞の認識しくっつく機能を改良し、N末端ドメイン(N-terminal domain、NTD)の変異は免疫系を回避するのに役立つかもしれない。S2領域の変異は細胞との融合や侵入の過程を促進するかもしれない。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
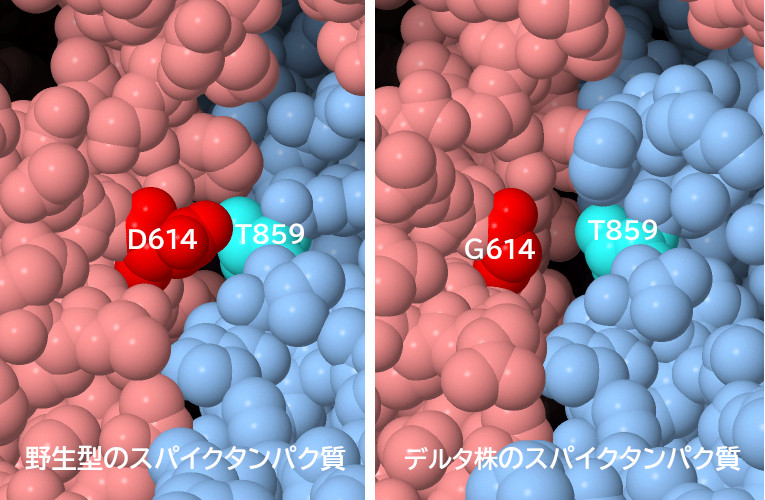
614番目(赤色で示す部分)のアスパラギン酸(aspartate)がグリシン(glycine)に変化すると、スパイク3量体で隣のサブユニットにある859番目(青緑色)のスレオニン(threonine)との相互作用がなくなる。これにより構造がゆるみ、伸びた受容体結合ドメインを伴った活性型構造へと遷移しやすくなるのだと考えられている。図の下のボタンをクリックして対話的操作のできる図に切り替え、614番目にアスパラギン酸を持った非変異型の構造(PDBエントリー6vyb)とグリシンを持った変異型デルタ株の構造(PDBエントリー7v7q)を比較してみて欲しい。
理解を深めるためのトピックス
- PDBアーカイブにはSARSコロナウイルス2型スパイクタンパク質の構造が何百件も登録されています。その全リストを見る簡単な方法の一つは、PDBjウェブサイトの上部にある検索ボックスにP0DTC2(UniProtのID)のキーワードを入力して検索してみることです。
- ウイルスと大流行について調べるのに役立つ資料の一覧がRCSB PDBのCOVID-19/SARS-CoV-2 Resources(英語)にあります。
参考文献
- 7lwt、7lyo 2021 Effect of natural mutations of SARS-CoV-2 on spike structure, conformation, and antigenicity. Biorxiv DOI:10.1101/2021.03.11.435037
- 2021 SARS-CoV-2 variants, spike mutations and immune escape. Nat Rev Microbiol 19 409-424
- 2021 Loss of furin cleavage sites attenuates SARS-CoV-2 pathogenesis. Nat 591 293-299
- 2021 Evolution of the SARS-CoV-2 proteome in three dimension (3D) during the first 6 months of the COVID-19 pandemic. Prot Struc Func Genet DOI:10.1002/prot.26250
- 2021 The total number and mass of SARS-CoV-2 virions. Proc Natl Acad Sci USA 118 e2024815118
- 7kj2 2021 A trimeric human angiotensin-converting enzyme 2 as an anti-SARS-CoV-2 agent. Nat Struct Mol Biol 28 202-209
- 6vyb 2020 Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell 181 281
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









