263: アセトヒドロキシ酸合成酵素(Acetohydroxyacid Synthase)
生命の進化過程において、生化学的・生物学的な機能は獲得されたり失われたりする。これは生物全体のレベルでも起こる。例えば、自然選択の結果、蝶は葉とそっくりになり捕食者に対する完全な偽装を獲得している。一方、洞窟に生息する動物は、生息する暗い環境の下における進化と自然選択の過程で徐々に色覚や視覚能力を徐々に失っていく。同じように、進化は分子のレベルでも起こる。植物には、環境にある単純な栄養素からすべてのアミノ酸を一から作り上げるのに必要な分子機構が備わっている。ところが、動物は進化の過程でこの能力を失ってしまった。私たちが食べる動植物には安定した量のアミノ酸が含まれているので、細胞がすべてのアミノ酸を作れる必要はないのだ。その代わり、細胞はこれらのアミノ酸を作るのに必要なエネルギーを、生存に必要な他の機能へと振り向けることができる。はるか昔のどこかで、私たちの細胞は9種類のアミノ酸をつくる能力を失った。そして今日、これらのアミノ酸は私たちの食事に必要がある必須アミノ酸(essential amino acids)に分類されている。
アミノ酸をつくる
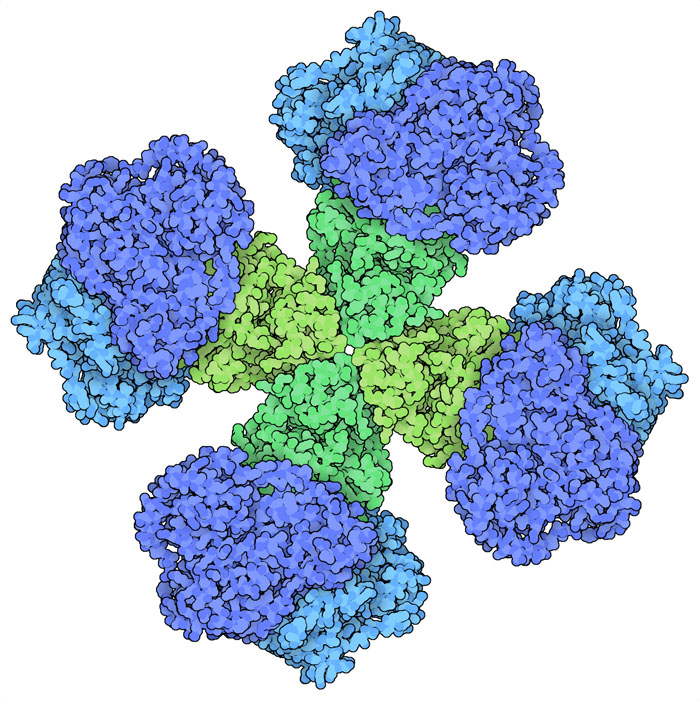
ロイシン(leucine)、バリン(valine)、イソロイシン(isoleucine)は私たちの食事に「必須」な3種類のアミノ酸である。これらはいずれも炭素と水素だけで構成され短く枝分かれした側鎖を持っており、まとめて分枝鎖アミノ酸(Branched Chain Amino Acid、BCAA)と呼ばれている。植物、細菌、菌類は解糖系(glycolysis)でつくられたピルビン酸(pyruvate)を使ってこれらのアミノ酸をつくることができる。酵素のアセトヒドロキシ酸合成酵素(acetohydroxyacid synthase、AHAS、ここに示すのはPDBエントリー6vz8の構造)は合成における最初の段階を行う。バリンをつくる際、この酵素は2分子のピルビン酸を使う。一方の分子から二酸化炭素を引き抜き、残った部分をもう一方の分子にくっつけてアミノ酸の大きさを持つ前駆体をつくる。次に、別の酵素3種類が分子内にある原子を入れ替え、「アミノ」基を付加してアミノ酸ができる。同様に、ロイシンをつくる際にも数種の酵素が必要である。イソロイシンの場合、2つ目のピルビン酸の代わりに少し大きな別の分子を使って合成が始まる。
合成の経路
私たちは、これらの生合成酵素が経路(pathway)に並んでいるという概念でとらえることがよくあり、この経路上で分子は次々と酵素に出会い、段階的に修飾されていく。往々にして、この経路上には「一旦通れば後戻りできない」(committed)段階を担う、鍵となるような酵素がある。例えば、AHASはバリンとロイシンの合成において最初の段階を行うが、この段階を経て2つのピルビン酸分子がつなげられ一つになると、これらのアミノ酸を生産することだけに使われることになる。後戻りできない段階は、後述するように生合成過程を制御する場所になっていることも多い。また、この場所は阻害剤によって合成経路を邪魔されやすい脆弱な場所ともなっている。広く使われている市販の除草剤の中には、AHASを標的とするものがたくさん存在する。これは魅力的な標的と言える。なぜならこれらの除草剤は不可欠な機能を阻害するので非常に効果的であるが、私たちはAHASを持たないので使用しても安全だからである。
フィードバックを得る
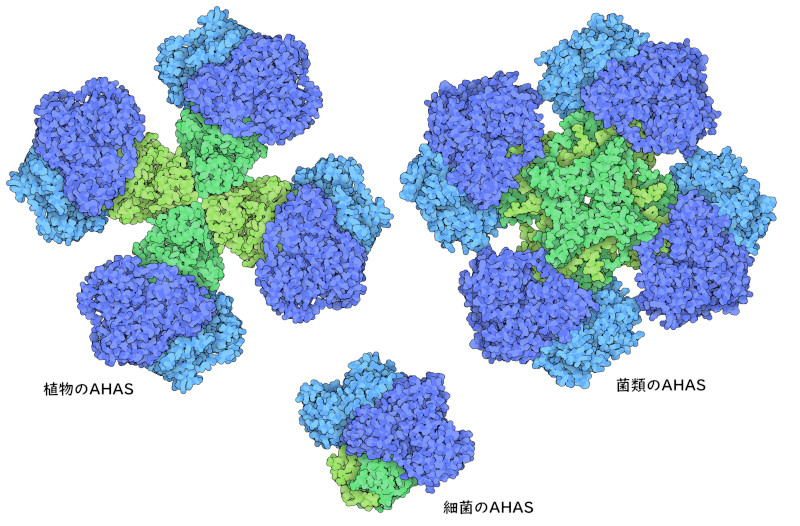
AHASはアミノ酸の合成において重要な段階を担っているので、酵素の活性を制御するよい候補となる。AHAS酵素は通常2つのサブユニットを持つ。一つは反応を行う触媒サブユニット(catalytic subunit)、もう一つは作用を制御する調節サブユニット(regulatory subunit)である。バリンが豊富にあると調節サブユニットに結合し、触媒サブユニットを活性の低い型へと変える。その結果分枝鎖アミノ酸の産生が遅くなる。しかし、バリン濃度が低いと、調節サブユニットに結合する分子の量が足らなくなり、複合体は完全に活性型へと戻る。別の生物を見てみると、触媒サブユニットは極めて似ているが、調節サブユニットはさまざまであることが分かる。ここには3つの事例を示す。植物のAHAS(PDBエントリー6vz8)には4つの大きな調節サブユニットがあるのに対し、菌類由来のAHAS(PDBエントリー6u9d)には大きさが植物の半分である調節サブユニットが8つある。また細菌のAHAS(PDBエントリー6lpi)にある調節サブユニットは2つで、複合体全体としてはより小さなものとなっている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
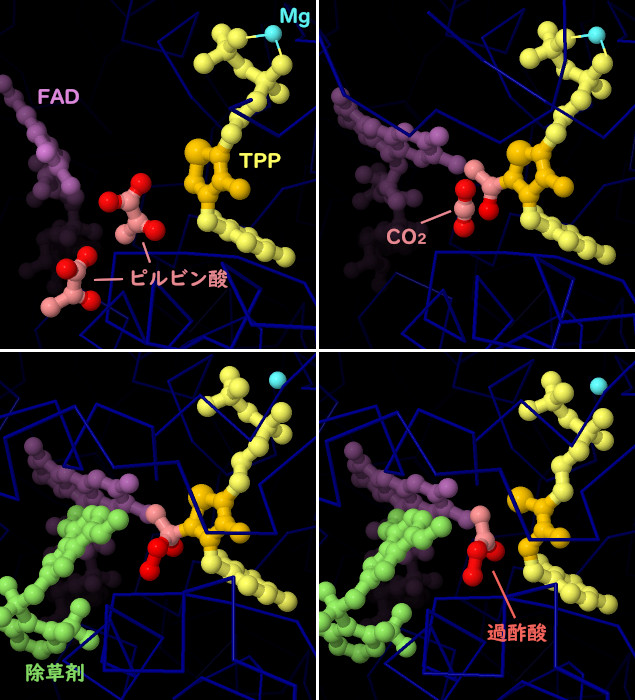
酵母に由来するAHASの結晶構造から、触媒反応の各段階や、除草剤がどのようにして反応を阻害するのかが明らかになっている。活性部位は反応を助けるのにいくつかの補因子を使う。チアミン補因子(thiamine cofactor、TPP、黄色で示す部分、反応性リングはオレンジ色で示す)は二酸化炭素を取り除く中心的な反応を行う。マグネシウムイオン(Mg、青緑色)は補因子を適切な位置に配置させる。AHASはFAD(赤紫色)にも結合するが、活性型酵素においてFADは還元状態になっていなければならない。またいくつかの酸素分子(ここには示していない)にも結合するが機能は分かっていない。PDBエントリー6bd9には活性部位に入った2分子のピルビン酸(赤色とピンク色)が含まれ、PDBエントリー6bd3ではこの一方がチアミン補因子に付加され二酸化炭素が除去された後の状態をとらえている。PDBエントリー5wkcには、活性部位への入り口を邪魔している除草剤分子(ペノキススラム、penoxsulam、緑色部分)が含まれている。これはさらなる問題も引き起こす。この構造において、付加された基質分子は反応性に富む酸化された分子に変換されてる。このPDBエントリーの別サブユニットでは、反応性分子(エタンペルオキソ酸、過酢酸、ethaneperoxoic acid)が放出され、壊れたリングを持つ損傷を受けたチアミン補因子が残っている。また、エタンペルオキソ酸はFADも酸化し、酵素の作用をさらに阻害する可能性がある。これらの構造をより詳しくみるため、図の下のボタンをクリックし対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- AHASの作用を阻害する除草剤にはいくつかの種類があり、いずれも基質が活性部位に入るのを阻害します。ただし、それぞれの構造や結合方法は少しずつ異なります。AHASのキーワードを使ってPDBjサイトで検索し、それらの構造を見てみてください。
- PDBアーカイブにあるさまざまなAHASの構造を調べると、いろいろな形や大きさの複合体が見つかることに注意してください。例えば、それら構造の多くには触媒サブユニットの2量体しか含まれませんが、除草剤が結合したときに集まって4量体を形成することがよくあります。そのため、この記事で示している特徴的な十字型の集合体は見られないでしょう。
参考文献
- 6vz8、6u9d 2020 Structures of fungal and plant acetohydroxyacid synthases. Nature 586 317-321
- 6lpi 2020 Molecular architecture of the acetohydroxyacid synthase holoenzyme. Biochem J 477 2439-2449
- 5wkc 2018 Structural insights into the mechanism of inhibition of AHAS by herbicides. Proc Natl Acad Sci U S A 115 E1945-E1954
- 6bd9、6bd3 2017 High resolution crystal structures of the acetohydroxyacid synthase-pyruvate complex provide new insights into its catalytic mechanism. ChemistrySelect DOI:10.1002/slct.201702128
- 2016 Acetohydroxyacid synthases: evolution, structure, and function. Appl Microbiol Biotechnol 100 8633-8649
- 2010 An evolutionary perspective on amino acids. Nature Education 3(9) 29
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









