257: 태아 헤모글로빈 (Fetal Hemoglobin)
이 기사는 2021년 1월에 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine) 주최로 개최된 1주일간의 집중 합숙 ‘생물의학에서의 과학 커뮤니케이션’(Science Communication in Biology and Medicine)의 일환으로 캔디스 크레이그(Candice Craig), 사만다 잉(Samantha Eng), 제나 만소(Jenna Manzo), 앤드루 치카센코(Andrew Tkacenko)에 의해 집필되고 그려진 것입니다.
산소를 공유하다
성장하는 태아는 산소나 필요한 영양분을 그 어머니로부터 얻지만 여기에는 어떤 특유의 과제가 있다. 그것은 모체의 혈액에서 태아에게 산소를 공급하는 특별한 구조가 필요하다는 것이다. 그것이 없으면 태아는 적절한 발달에 필요한 충분한 산소를 받을 수 없기 때문이다. 다행히 태아는 이에 대처할 수단을 갖추고 있다. 그것이 태아 헤모글로빈(fetal hemoglobin)이다! 이것은 인간 태아가 가진 적혈구의 주요 산소 수송 단백질이며, 모체에 있는 헤모글로빈과의 근소한 차이로 인해 모체에서 태아로 효율적으로 산소가 교환될 수 있도록 한다.
필수적인 효율적 교환
태아 헤모글로빈은 피할 수 없는 딜레마를 해결해 준다. 헤모글로빈 분자에서 다른 헤모글로빈 분자로 산소를 어떻게 전달하면 좋을까? 태아 헤모글로빈은 정상적이고 건강한 조건하에서 성인 헤모글로빈보다 높은 산소 친화성을 가짐으로써 이 기발한 재주를 부리고 있다. 임신 중에 모체의 헤모글로빈은 산소를 방출하고 그 산소는 태반을 통해 태아 헤모글로빈으로 흡수된다. 태아 헤모글로빈은 임신의 마지막 3분의 2 기간에는 우위를 점하지만 태어난 지 1년이 지날 때까지 몸에서 만들어지는 헤모글로빈은 성인형이 되고 태아 헤모글로빈은 거의 만들어지지 않게 된다.
2개의 서브유닛에 의한 한 가지 큰 차이
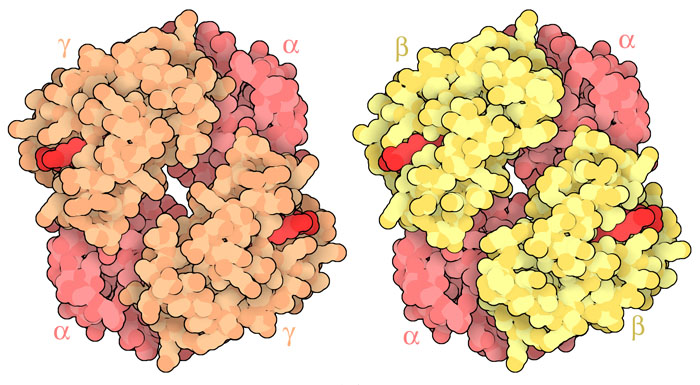
헤모글로빈은 태아형과 성인형 모두 4개의 서브유닛으로 구성되어 있다. 모두 2개의 α 서브유닛을 가지고 있지만 성인 헤모글로빈에서는 2개의 β 서브유닛으로 되어 있는 부분이 태아 헤모글로빈에서는 2개의 γ 서브유닛으로 대체되어 있다(여기에서는 PDB 엔트리 4hhb와 1fdh의 구조를 나타냄). 이 γ 서브유닛에 의해 태아 헤모글로빈의 산소 친화성이 향상되어 있다. 적혈구와 태반의 세포는 2,3-BPG(2,3-비스포스포글리세린산, 2,3-bisphosphoglycerate)라고 불리는 작은 유기인 분자를 만든다. 2,3-BPG는 성인 헤모글로빈에 결합하여 산소 친화성을 낮추지만 태아 헤모글로빈에는 그다지 강하게 결합하지 않는다. 그래서 2,3-BPG에 의해 성인 헤모글로빈에서는 산소가 유리되고 태아 헤모글로빈이 산소를 붙잡을 수 있게 된다. 산소 친화성에 관한 이 차이로 인해 산소가 모체에서 태아로 전달되는 것이다.
낫적혈구빈혈에 대한 하나의 해결책이 된다?
태아 헤모글로빈이 낫적혈구빈혈(sickle cell disease) 치료에도 사용할 수 없는지 시험 중이다. 이 병은 β 서브유닛의 변이에 의해 일어나는 것으로, 헤모글로빈이 섬유를 만들어 적혈구 세포가 비정상적인 낫 모양이 되어버리는 문제를 일으킨다. 태아 헤모글로빈은 β 서브유닛을 갖고 있지 않기 때문에 이 병을 일으키는 변이를 갖지도 않는다. 그렇기 때문에 낫적혈구 유전자를 가진 유아는 낫적혈구빈혈 증상이 나타나지 않는다. 그것은 그들이 만드는 헤모글로빈의 대부분은 태아 헤모글로빈이기 때문이다. 하지만 아이가 자라면서 헤모글로빈이 성인형으로 바뀌면 문제가 생기기 시작한다.
태아헤모글로빈의 유전적 존속(hereditary persistence of fetal hemoglobin)이라는 희귀한 유전적 조건을 가진 사람들을 조사함으로써 치료방법의 후보가 발견됐다. 이들은 어른이 되어서도 보통보다 높은 농도의 태아 헤모글로빈을 갖고 있으며, 낫적혈구 변이도 갖고 있지만 증상이 심각하지는 않다. 연구 결과, 혈중 헤모글로빈의 약 20%가 태아 헤모글로빈이면 낫적혈구빈혈 증상을 억제하기에 충분한 것으로 나타났다. 이를 바탕으로 낫적혈구 변이를 가진 사람들에게 태아 헤모글로빈 농도를 늘리는 유전자 치료가 이루어지고 있다. 그 치료에서는 태아 헤모글로빈 유전자 사일렌서(유전자 제어 부위에 결합해 발현을 억제하는 단백질) BCL11A(PDB 엔트리 6ki6)의 작용이 억제된다. 이를 통해 태아 헤모글로빈이 만들어지고 낫적혈구빈혈 증상이 개선된 것으로 나타났다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
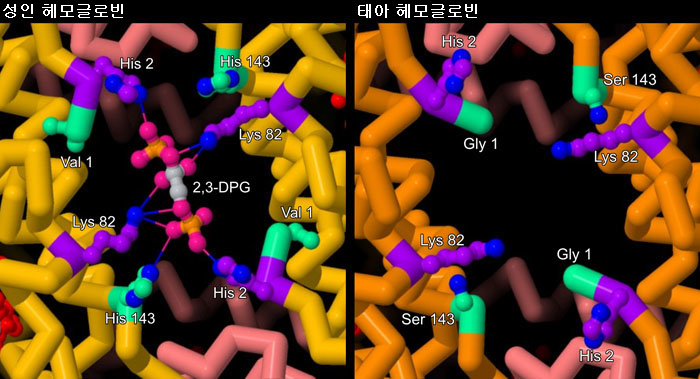
산소가 없으면 2,3-BPG는 성인 헤모글로빈에 있는 β 서브유닛의 패임에 꼭 맞아 들어가 음의 전기를 띤 인산과 양의 전기를 띤 아미노산(보라색으로 나타낸 부분) 사이에서 상호 작용한다. 반대로 태아 헤모글로빈의 γ사슬(그림 우측, PDB 엔트리 1fdh)에서는 2,3-BPG와 상호 작용하는 데 필요한 중요한 장소에 다른 아미노산(민트 그린으로 나타낸 부분)이 있다. 더욱이 이들 아미노산이 교체됨으로써 양의 전기를 띤 아미노산 간의 거리가 너무 멀어져 2,3-BPG와 결합할 수 없게 된다. 이들 차이로 인해 2,3-BPG는 태아 헤모글로빈보다 성인 헤모글로빈에 더 강하게 결합하여 작용을 억제한다. 2,3-BPG 농도가 높은 태반에서 태아 헤모글로빈은 성인 헤모글로빈보다도 강하게 산소와 결합할 수 있다. 이러한 구조를 보다 자세하게 보기 위해 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 이미지로 전환해 보기 바란다.
이해를 높이기 위한 토픽
- 효소의 2,3-비스포스포글리세르산 변위효소(2,3-bisphosphoglycerate mutase)는 2,3-BPG를 만듭니다. PDB에는 다양한 반응 단계를 포착한 이 효소의 구조가 등록되어 있습니다. 예를 들어 PDB 엔트리 2h4z를 보십시오.
- 헤모글로빈은 2,3-BPG 이외에도 다양한 방법을 사용하여 잘 제어되고 있습니다. 예를 들어 이달의 분자의 기사 S-니트로실화 헤모글로빈(S-nitrosylated hemoglobin)을 보십시오.
참고문헌
- 1b86 1993 Human deoxyhaemoglobin-2,3-diphosphoglycerate complex low-salt structure at 2.5 A resolution. Journal of Molecular Biology. 233(2) 270-274
- 1fdh 1977 Structure of human foetal deoxyhaemoglobin. Journal of Molecular Biology 112 97-112
- 4hhb 1984 The crystal structure of human deoxyhaemoglobin at 1.74 Å resolution. Journal of Molecular Biology 175 (2) 159-174
- 6ki6 2019 Structural insights into the recognition of γ-globin gene promoter by BCL11A. Cell Research 29 960-963
- 1997 Amino acids responsible for decreased 2,3-biphosphoglycerate binding to fetal hemoglobin. Blood 90(8) 2916-2920
- 2021 Post-transcriptional genetic silencing of BCL11A to treat sickle cell disease. The New England Journal of Medicine 384 205-215
- 1943 The oxygen affinity of human maternal and foetal haemoglobin. The Journal of Physiology 102(1) 55–61
- 2006 Novel placental expression of 2,3-bisphosphoglycerate mutase. Placenta 27 924-927
- 2008 Hemoglobin Research and the origins of Molecular Medicine. Blood 112 (10) 3927–3938
- 1981 Modulation of the oxygen equilibria of human fetal and adult hemoglobins by 2,3-Diphosphoglyceric Acid. The Journal of Biological Chemistry 256 9495-9500
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









