258: 당질 코르티코이드 수용체 및 덱사메타손 (Glucocorticoid Receptor and Dexamethasone)
이 기사는 2021년 1월에 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine) 주최로 개최된 1주일간의 집중 합숙 ‘생물의학에서의 과학 커뮤니케이션’(Science Communication in Biology and Medicine)의 일환으로 제나 아브야드(Jenna Abyad), 탄비 바노타(Tanvi Banota), 잣카리 프리츠(Zachary Fritz), 알렉산드리아 로(Alexandria Lo)에 의해 집필되고 그려진 것입니다.
SARS 코로나바이러스 2형 감염증과 싸우다
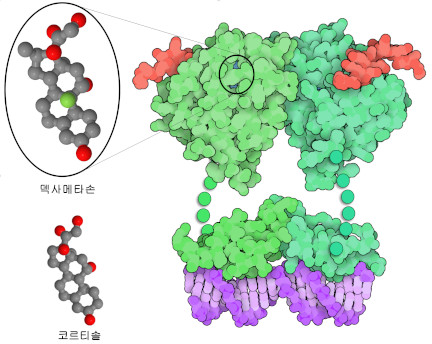
당질 코르티코이드(Glucocorticoid, 글루코코르티코이드) 약은 염증과 자가면역질환을 치료하기 위해 널리 처방되고 있으며 최근에는 COVID-19(SARS 코로나바이러스 2형 감염증)의 중증 환자 치료에도 사용되고 있다. COVID-19는 발열이나 숨가쁨 등의 증상에서 복합장기부전 등의 중한 합병증으로 빠르게 진행된다. 중증 환자는 ‘사이토카인 폭풍’(cytokine storm)을 겪는데 이때는 더 이상 코로나 바이러스에 대한 염증 반응을 억제할 수 없어 사이토카인(염증의 분자 메신저)의 비정상적인 생산이 추가 합병증을 일으킨다. 임상시험에서는 당질 코르티코이드 수용체에 결합하는 강력한 항염증제인 덱사메타손(dexamethasone)을 저용량으로 투여함으로써 COVID-19 입원 환자의 사망률이 낮아진 것으로 나타났다.
이동 중인 수용체
당질 코르티코이드는 에스트로겐 수용체(estrogen receptor)와 함께 핵 내 수용체의 동료(패밀리)에 속해 있다. 이는 리간드 결합 도메인(ligand-binding domain), DNA 결합 도메인(DNA-binding domain), 트랜스 활성화 도메인(transactivation domain) 등 세 부분으로 구성되어 있다. 사람의 경우 이 수용체의 리간드로 가장 흔한 것이 스트레스 호르몬 중 하나인 코르티솔(cortisol)이다. 수용체가 코르티솔에 결합하면 수용체 구조가 변화해 세포질에서 핵으로 이동한다. 핵 내에서는 표적 DNA 배열에 결합해 유전자 발현에 영향을 줄 수 있다. 당질 코르티코이드 수용체는 활성화 보조인자(coactivator)와도 상호 작용을 하여 유전자 발현 구조를 더욱 조절할 수 있다. 수용체는 유연한 링커로 연결된 몇 개의 도메인으로 구성되어 있으므로 도메인의 구조는 따로 결정되었다. 덱사메타손에 결합한 리간드 결합 도메인의 구조는 PDB 엔트리 1m2z, DNA에 결합한 DNA 결합 도메인의 구조는 PDB 엔트리 1glu인 것을 나타낸다. 트랜스 활성화 도메인은 여기에 나타내지 않는다. 이 도메인들이 모두 함께 모여 코르티솔 결합에 의해 야기되는 첫 번째 메시지가 전달된다.
과도한 염증
약(藥)인 덱사메타손의 구조는 천연 코르티솔의 구조와 매우 흡사하다. 이에 따라 덱사메타손은 당질 코르티코이드 수용체에 딱 맞게 결합해 동일하게 체내 염증을 해소하는 유전자 발현의 변화를 일으킨다. 이 활성 때문에 덱사메타손은 COVID-19치료에 특히 효과적이다. 왜냐하면 코로나바이러스로 인한 손상은 바이러스 자체에 의한 것뿐만 아니라 제어할 수 없는 염증에 의한 것이기도 하기 때문이다. 그런데 덱사메타손의 항염증 효과는 사용법이나 시기를 잘못 맞추면 해를 끼칠 수 있다. COVID-19의 초기 단계에서 신체는 바이러스를 격퇴하기 위해 면역계를 동원해야 하므로 초기의 중증이 아닌 환자에게 덱사메타손을 사용하면 섣불리 환자 상태를 악화시킬 수 있다.
덱사메타손 복용: 그것은 복잡하다
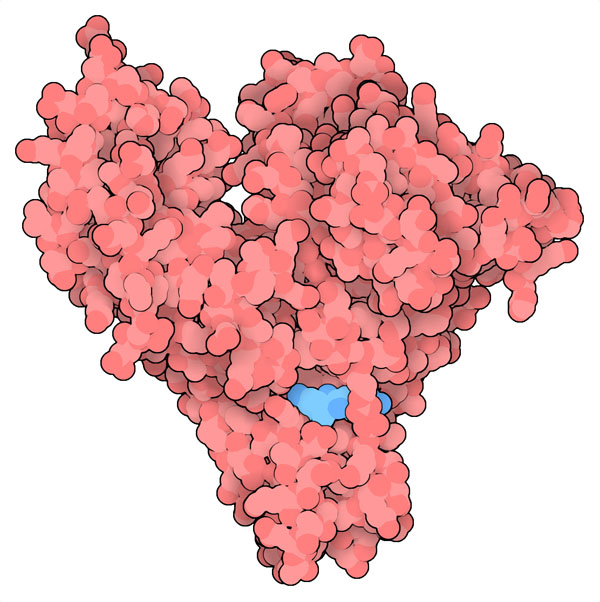
혈청 알부민(serum albumin)은 혈장 중 가장 풍부하게 볼 수 있는 단백질이지만 덱사메타손도 다른 약이나 호르몬과 마찬가지로 이 혈청 알부민에 의해 몸 전체로 운반된다. 그런데 이 단백질과 관련된 인자 때문에 COVID-19와 관련된 염증을 치료할 때 안전하고 효과적일 수 있도록 덱사메타손을 투여하기 어렵다. 예를 들어 당뇨병 환자에서는 단백질 중의 중요한 아미노산에 대해 당화(glycation) 과정을 거쳐 당 분자가 결합한 경우가 흔하다. 이렇게 되면 약의 단백질 결합이 방해될 수 있다. 이부프로펜(ibuprofen)과 같은 일반적 진통제 등도 혈청 알부민 상에 있는 같은 결합 부위를 사용해 경합하므로 동시에 복용하면 덱사메타손의 수송이 방해된다. 여기에 간장병, 영양실조, 고령 등 COVID-19위험인자에 더해 바이러스 자신도 환자의 혈청 알부민 농도를 낮출 수 있다. 이 복잡한 사정으로 내과의사가 혈중 덱사메타손의 유리:결합의 상대비를 어림잡아 약의 독성 증가, 부작용, 약효 저하를 초래할 가능성에 대해 판단하기 어렵게 되어 있다.
구조 보기
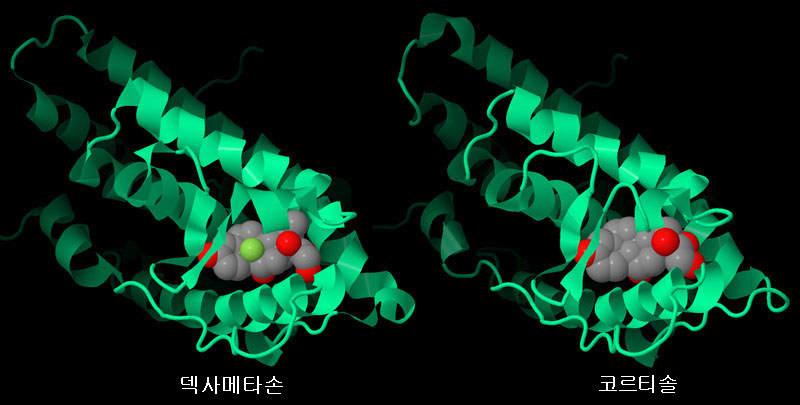
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
덱사메타손이 결합한 구조(왼쪽, PDB 엔트리 1m2z)와 코르티솔이 결합한 구조(오른쪽, PDB 엔트리 4p6x) 모두에 대해 리간드 결합 도메인의 구조를 얻었다. 이들 리간드는 구조가 매우 흡사하여 당질 코르티코이드 수용체의 같은 패임에 결합한다. 리간드는 원자종별로 색상을 구분한 구로, 당질 코르티코이드 수용체는 녹색 리본 모델로 나타내고 있다. 이러한 구조를 보다 자세하게 보기 위해 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 그림으로 전환해 보기 바란다.
이해를 높이기 위한 토픽
- 이달의 분자의 기사 ‘인터페론’(interferon)에는 바이러스 감염에 응답해 만들어지는 사이토카인의 예를 들고 있습니다.
- 코로나바이러스의 구조생물학에 대해 더 자세히 배우고 싶다면 RCSB PDB의 PDB-101-코로나바이러스 관련 자료(영어)를 확인해 보십시오.
- COVID-19 치료에 대한 권장 치료제 가이드라인에 대해 더 자세히 배우고 싶다면 미국국립보건연구소(NIH)의 치료 가이드라인(영어)을 참조하십시오. 또한 PDB-101 COVID-19-분자의 세부 정보에 관한 커리큘럼 모듈(영어)도 참조하십시오.
- 당질 코르티코이드 수용체와 같은 핵 수용체에 대해 더 자세히 배우고 싶다면 이달의 분자의 기사 에스트로겐 수용체(estrogen receptor)나 비타민 D 수용체(vitamin D receptor)를 참조하십시오.
참고문헌
- 6xk0 2020 Molecular determinants of vascular transport of dexamethasone in COVID-19 therapy. IUCrJ 7 1048-1058
- 4p6x 2014 Structures and mechanism for the design of highly potent glucocorticoids. Cell Res. 24 713-726
- 1glu 1991 Crystallographic analysis of the interaction of the glucocorticoid receptor with DNA. Nature 352 497-505
- 4k2c 2013 Structural mechanism of ring-opening reaction of glucose by human serum albumin. J Biol Chem 288 15980-15987
- 4k2c 2013 Structural mechanism of ring-opening reaction of glucose by human serum albumin. J Biol Chem 288 15980-15987
- 2014 Comprehensive Overview of the Structure and Regulation of the Glucocorticoid Receptor. Endocrine Rev 35(4) 671-693
- 2013 The biology of the glucocorticoid receptor: New signaling mechanisms in health and disease. J Allergy Clin Immunol 132(5) 1033-1044
- 2013 The five Rs of glucocorticoid action during inflammation: ready, reinforce, repress, resolve, and restore. Trends Endocrinol Metab 24(3) 109-119
- 2020 Steroids in COVID-19: An overview. Cleve Clinic J Med. DOI:10.3949/ccjm.87a.ccc05 Epub ahead of print.
- 2001 Novel glucocorticoid receptor coactivator effector mechanisms. Trends Endocrinol Metab. 12(3) 122-126
- 2002 Cell 110 93-105
- 2014 Structures and mechanism for the design of highly potent glucocorticoids. Cell Res. 24 713-726
- 1991 Crystallographic analysis of the interaction of the glucocorticoid receptor with DNA. Nature 352 497-505
- 2020 Molecular determinants of vascular transport of dexamethasone in COVID-19 therapy. IUCrJ 7 1048-1058
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









