257: 胎児ヘモグロビン(Fetal Hemoglobin)
酸素を共有する
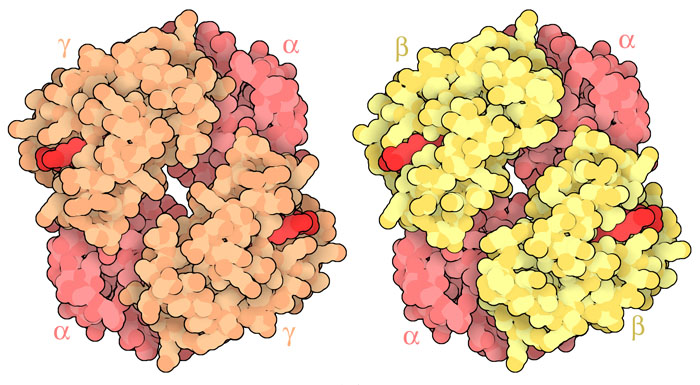
成長している胎児は酸素や必要な栄養分をその母親から得ているが、ここにはある特有の課題がある。それは、母体の血液から胎児に酸素を供給する特別なしくみが必要ということである。それがないと、胎児は適切な発達に必要となる十分な酸素を受け取ることができないからである。幸い、胎児はこれに対処する手段を備えている。それが胎児ヘモグロビン(fetal hemoglobin)だ!これはヒトの胎児が持つ赤血球の主要な酸素輸送タンパク質であり、母体にあるヘモグロビンとのわずかな違いによって、母体から胎児へと効率的に酸素が交換できるようにしている。
不可欠な効率的交換
胎児ヘモグロビンは避けられないジレンマを解決してくれる。どうやってヘモグロビン分子から別のヘモグロビン分子に酸素を渡せばいいのだろうか? 胎児ヘモグロビンは、正常で健康的な条件下で大人のヘモグロビンよりも高い酸素親和性を持つことによりこの離れ業を成し遂げている。妊娠中、母体のヘモグロビンは酸素を放出し、その酸素は胎盤を通って胎児ヘモグロビンに取り込まれる。胎児ヘモグロビンは妊娠の最後3分の2の期間には優位を占めているが、生まれて1年経つまでに身体でつくられるヘモグロビンは大人型となり胎児ヘモグロビンはほとんどつくられなくなる。
2つのサブユニットによる一つの大きな違い
ヘモグロビンは胎児型も大人型も4つのサブユニットで構成されている。どちらも2つの
鎌形赤血球貧血症に対する一つの解決策になる?
胎児ヘモグロビンが鎌形赤血球貧血症(sickle cell disease)の治療にも使えないか試験されている。この病気は、βサブユニットの変異によって起きるもので、ヘモグロビンが線維をつくり赤血球細胞が異常な鎌形になってしまう不具合を引き起こす。胎児ヘモグロビンはβサブユニットを持っていないので、この病気を起こす変異を持つこともない。そのため、鎌形赤血球遺伝子を持つ幼児は鎌形赤血球貧血症の症状が出ない。それは彼らがつくるヘモグロビンのほとんどは胎児ヘモグロビンだからである。しかし、子供が成長するにつれヘモグロビンが大人型に入れ替わると問題が出始める。
遺伝性高胎児ヘモグロビン血症(hereditary persistence of fetal hemoglobin)という稀な遺伝的条件を持った人々を調べることにより治療方法の候補が見つかった。彼らは大人になっても通常よりも高い濃度の胎児ヘモグロビンを持ち、鎌形赤血球の変異も持っているが、症状は重くはない。研究の結果、血中ヘモグロビンの約20%が胎児ヘモグロビンであれば鎌形赤血球貧血症の症状を抑えるのに十分であることがわかっている。それを踏まえ、鎌形赤血球の変異を持つ人々に対して胎児ヘモグロビンの濃度を増やす遺伝子治療が行われている。その治療では、胎児ヘモグロビン遺伝子のサイレンサー(遺伝子の制御部位に結合して発現を抑制するタンパク質)BCL11A(PDBエントリー6ki6)の働きが抑えられる。これにより胎児ヘモグロビンがつくられ、鎌形赤血球貧血症の症状が改善したことが示されている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
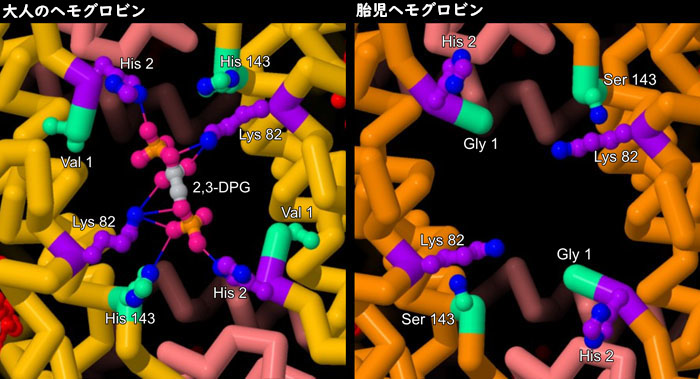
酸素がないと、2,3-BPGは成人ヘモグロビンにあるβサブユニットの窪みにぴったりとはまり、負の電気を帯びたリン酸と、正の電気を帯びたアミノ酸(紫で示す部分)との間で相互作用する。逆に、胎児ヘモグロビンのγ鎖(図右側、PDBエントリー 1fdh)では、2,3-BPGと相互作用する上で必要となる重要な場所に別のアミノ酸(ミントグリーンで示す部分)がある。さらに、これらのアミノ酸が入れ替わったことで、正の電気を帯びたアミノ酸同士の距離が遠くなり過ぎ、2,3-BPGと結合できなくなる。これらの違いによって、2,3-BPGは胎児ヘモグロビンよりも大人のヘモグロビンにより強く結合し働きを抑制する。2,3-BPGの濃度が高い胎盤において、胎児ヘモグロビンは大人のヘモグロビンよりも強く酸素と結合することができる。これらの構造をより詳しくみるため、図の下のボタンをクリックして対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- 酵素の2,3-ビスホスホグリセリン酸ムターゼ(2,3-bisphosphoglycerate mutase)は2,3-BPGをつくります。PDBにはさまざまな反応段階をとらえたこの酵素の構造が登録されています。例えばPDBエントリー 2h4z を見てみてください。
- ヘモグロビンは2,3-BPG以外にもさまざまな方法を使ってしっかり制御されています。例えば、今月の分子の記事 S-ニトロシル化ヘモグロビン(S-nitrosylated hemoglobin)を見てみてください。
参考文献
- 1b86 1993 Human deoxyhaemoglobin-2,3-diphosphoglycerate complex low-salt structure at 2.5 A resolution. Journal of Molecular Biology. 233(2) 270-274
- 1fdh 1977 Structure of human foetal deoxyhaemoglobin. Journal of Molecular Biology 112 97-112
- 4hhb 1984 The crystal structure of human deoxyhaemoglobin at 1.74 Å resolution. Journal of Molecular Biology 175 (2) 159-174
- 6ki6 2019 Structural insights into the recognition of γ-globin gene promoter by BCL11A. Cell Research 29 960-963
- 1997 Amino acids responsible for decreased 2,3-biphosphoglycerate binding to fetal hemoglobin. Blood 90(8) 2916-2920
- 2021 Post-transcriptional genetic silencing of BCL11A to treat sickle cell disease. The New England Journal of Medicine 384 205-215
- 1943 The oxygen affinity of human maternal and foetal haemoglobin. The Journal of Physiology 102(1) 55–61
- 2006 Novel placental expression of 2,3-bisphosphoglycerate mutase. Placenta 27 924-927
- 2008 Hemoglobin Research and the origins of Molecular Medicine. Blood 112 (10) 3927–3938
- 1981 Modulation of the oxygen equilibria of human fetal and adult hemoglobins by 2,3-Diphosphoglyceric Acid. The Journal of Biological Chemistry 256 9495-9500
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









