233: S-ニトロシル化ヘモグロビン(S-Nitrosylated Hemoglobin)
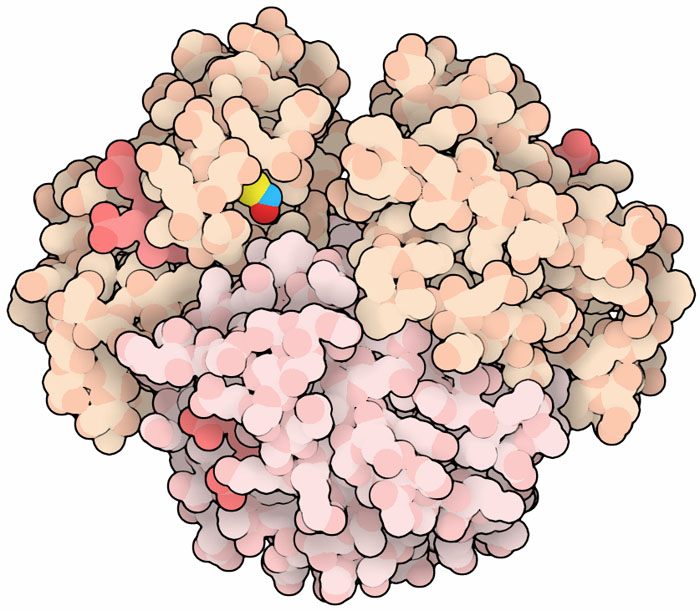
私たちの循環器系は進化の過程でうまく調整され、酸素を素早く効率的に行き渡らせるようになった。 ヘモグロビン(hemoglobin)はこれにぴったりな一例で、複合体のアロステリックな動き(訳注:酸素が結合するとヘモグロビンの構造が変化し次の酸素がより結合しやすくなるという動き)を通じ、肺で大量の酸素を取り込み、そのほとんどを身体の至るところで放出する。より多くの酸素を必要とする組織は、近くの血管を広げることにより血液の取り分をさらに増やすことができる。そうすることで、血流は増えより多くの酸素が放出されるようになる。驚くべきことに、ヘモグロビンは一酸化窒素(nitric oxide)ガスの助けを借り、この血流制御にも重要な役割を果たしている。
一酸化窒素による信号
一酸化窒素合成酵素(nitric oxide synthase)によってつくられる一酸化窒素は、特に血管の拡張を制御するのに用いられる信号伝達分子である。活性化されると、タンパク質中にあるアミノ酸のシステインと複合体を形成する。この複合体は容易に分かれた状態に戻ることができる。この性質は血流に関する自律的な制御系をつくることにつながっている。まず、一酸化窒素はヘモグロビンのβ鎖にある特定のシステイン(cystein)と複合体をつくる。このとき、酸化型と優先的に結合する。そして、血液が組織を通るとヘモグロビンは酸素を放出して脱酸素型に変化し、一酸化窒素も放出される。最後に、赤血球から運び出されて取り囲む血管を拡張させ、組織を流れる血流を増やす。
保存されたシステイン
こうしてヘモグロビンは酸素を運ぶだけではなく酸素を検知する役割も果たし、酸素を最も必要とする場所に一酸化窒素を放出している。この機能は大変重要なので、このシステイン(β鎖のCys93)はすべての哺乳類と鳥類を通して保存されているアミノ酸の一つになっている。このように保存されたアミノ酸は三つだけで、あとの二つはともにヘムのある場所にある。この反応は極めて特異的でもある。ヘモグロビンは他にもシステインをもっているが、、一酸化窒素が優先的に結合するのは2本のβ鎖それぞれにあるこのシステインである。そのことはPDBエントリー1buwで確認できる。
一酸化窒素の輸送
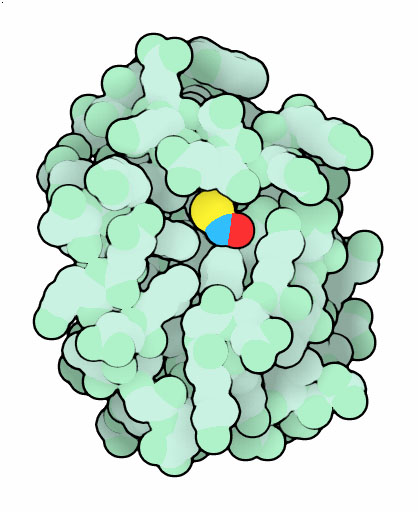
さまざまな種類のタンパク質がキーとなるアミノ酸のシステインに一酸化窒素を付加することにより制御されている。この反応は、二つのシステイン間での直接移動や特定の酵素の助けを借りたりするものを含むいくつかのしくみを通して起こっている。チオレドキシン(thioredoxin)は輸送する際、便利な輸送体として中心的な役割を果たしていると考えられている。PDBエントリー2ifqで見られるように、一酸化窒素は一方の側でシステインと反応し、標的となるタンパク質に一酸化窒素を転移する反応では供与体として働く。
構造をみる
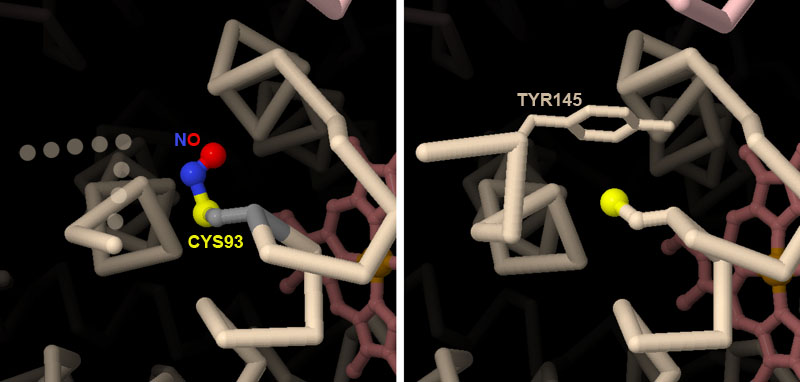
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
S-ニトロシル化ヘモグロビン(S-nitrosylated hemoglobin、PDBエントリー1buw)の構造は、まず一酸化炭素が結合したヘモグロビンの結晶を用意し、それを一酸化窒素ガスにさらすという方法で決定された。一酸化炭素結合型ヘモグロビンは酸化型ヘモグロビンと似た構造をしているので、一酸化窒素が結合してもあまり変化せず、鎖の末端にある2つのアミノ酸(145番と146番)の構造が不定になるだけであった。図の下のボタンをクリックして対話的操作のできる画像に切り替え、S-ニトロシル化ヘモグロビンと一酸化炭素が結合したヘモグロビン(PDBエントリー1hco)の構造をより詳しく見てみてほしい。
理解を深めるためのトピックス
参考文献
- 2015 Hemoglobin betaCys93 is essential for cardiovascular function and integrated response to hypoxia. Proc. Natl. Acad. Sci. USA 112 E2846
- 2013 S-Nitrosylation: specificity, occupancy, and interaction with other post-translational modifications. Antioxid. Redox Signal. 19 1209-1219
- 2013 Regulation of protein function and signaling by reversible cysteine S-nitrosylation. J. Biol. Chem. 288 26473-26479
- 2007 Buried S-nitrosocysteine revealed in crystal structures of human thioredoxin. Biochemistry 46 1219-1227
- 1998 Crystal structure of the S-nitroso form of liganded human hemoglobin. Biochemistry 37 16459-16464
- 1980 The structure of human carbonmonoxy haemoglobin at 2.7 A resolution. J.Mol.Biol. 136 103-128
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









