255: 시스플라틴과 DNA (Cisplatin and DNA)
이 기사는 2021년 1월에 정량생물의학 럿거스연구소(Rutgers Institute for Quantitative Biomedicine) 주최로 개최된 1주일간의 집중 합숙 ‘생물의학에서의 과학 커뮤니케이션’(Science Communication in Biology and Medicine)의 일환으로 헬렌 가오(Helen Gao), 사무엘 G. 슈렘(Samuel G. Shrem), 사이 스랴나나난(Saai Suryanarayanan)에 의해 집필되고 그려진 것입니다.
놀라운 약, 시스플라틴
질병 치료율을 5%에서 80%로 올리는 약을 상상해 보라. 시스플라틴(cisplatin)은 2개의 아민(amine)과 2개의 염화 이온(chloride)에 플래티넘(platinum)이 결합된 작은 분자로 이런 큰 변혁을 가져온 약이다. 1970년대 중반에 정소암(testicular cancer) 치료에 매우 효과적인 것으로 나타났다. 시스플라틴은 사슬 안에 있는 이웃한 구아닌 염기(guanine base)를 연결함으로써 DNA에 가교를 만든다. 이 가교에 의해 DNA는 휘어지고 정상적인 기능이 방해되어 세포와 그 게놈에 손상을 준다. 시스플라틴은 정소암 외에 난소암(ovarian cancer)이나 결합 조직의 종양 치료에도 사용할 수 있는 약으로 FDA에서 가장 초기에 승인된 약 중 하나다.
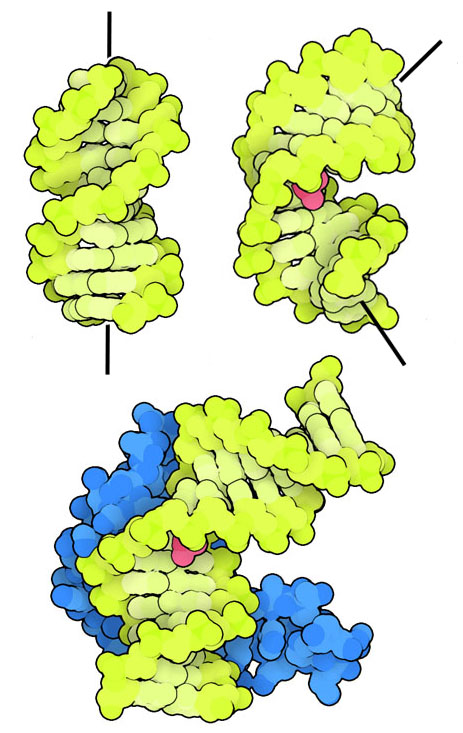
시스플라틴이 작용하는 모습
시스플라틴은 DNA의 배향을 변화시키고, 그에 따라 단백질과 상호 작용 방법을 변화시켜 세포에 영향을 미친다. 여기에 나타나듯이 일반적인 DNA(PDB 엔트리 3dnb)는 곧지만 시스플라틴이 결합된 DNA(PDB 엔트리 3lpv)는 화학 수식 부위에서 휘어져 있다. DNA 결합 패밀리 중에서도 높은 이동성을 갖는 단백질군(high mobility group DNA-binding family, HMG 도메인 단백질)은 휘어진 DNA에 결합하는 것을 선호하기 때문에 PDB 엔트리 1ckt에서 볼 수 있듯이 휘어진 시스플라틴 결합 DNA에 결합하는 것이다. 그리고 HMG 단백질은 시스플라틴에 의해 손상된 DNA를 DNA의 복제, 복구, 전사와 관련된 다른 단백질로부터 보호한다. 이런 일들이 쌓여 아포토시스(apoptosis, 프로그램 세포사)가 일어난다.
세포는 치료에 저항한다?
시스플라틴은 여러 종류의 사람의 암을 치료하는 데 매우 효과적이다. 하지만 종양은 몇 가지 방법으로 시스플라틴 치료에 대한 저항성을 발달시킬 수 있다. 그 방법에는 세포막의 내외를 초월한 시스플라틴의 수송을 변화시켜 세포사를 일으키는 구조의 작용을 억제하는 방법이 포함된다. 그 저항성을 극복하고, 더욱 잘 듣고 독성이 더 적은 약을 발견하는 데 구조 연구는 중요하다. 예를 들어 시스플라틴과 화학적으로 비슷한 옥살리플라틴(oxaliplatin)은 시스플라틴에 대한 저항성을 획득한 모종의 종양을 치료하는 데 효과적인 것으로 나타났다.
혼란스러운 단백질
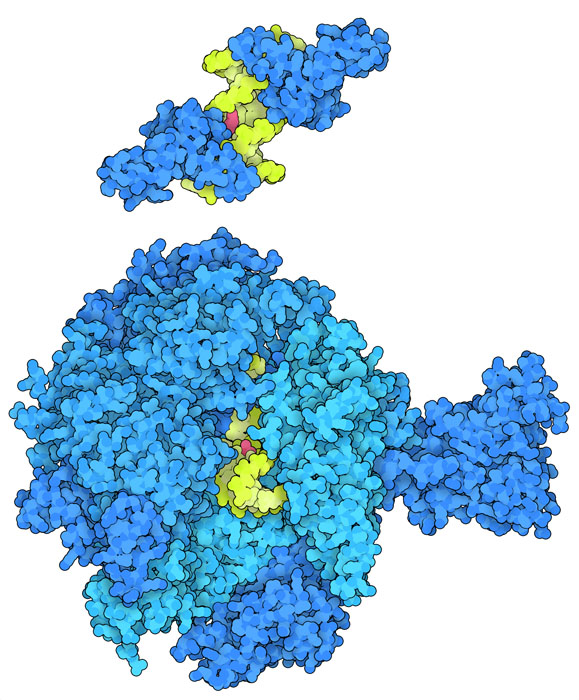
시스플라틴이 결합한 DNA는 DNA의 복구와 전사에 관계된 단백질이 갖는 정상적인 기능을 저하시킨다. 뉴클레오타이드 절제 복구(nucleotide excision repair, NER) 과정에서는 화학물질이나 방사선에 의해 DNA에 생긴 큰 이상 부분(DNA 손상 영역)을 잘라내어 제거하는 것이 일반적이다. 예를 들어 NER 단백질의 일종인 XPA는 손상된 나선 양쪽에서 휘어진 DNA에 결합한다. 그 모습을 PDB 엔트리 5a39에서 볼 수 있다. 그리고 XPA는 DNA의 양 사슬에 루프를 삽입하고 이 영역에서 DNA 사슬을 단일가닥으로 분리한다. 이렇게 함으로써 다른 NER 단백질이 결합하여 DNA 손상 영역 전체를 제거할 수 있다. 하지만 HMG 단백질이 시스플라틴-DNA 복합체에 결합하면 이 방어가 방해되어 손상이 지속될 지도 모른다. 시스플라틴이 결합한 DNA는 세포의 DNA를 RNA로 전사하는 RNA 중합효소II(RNA polymerase II, PDB 엔트리 2r7z)의 작용도 저해할 지도 모른다. 시스플라틴이 DNA에 결합하면 부피가 커진 손상 영역에서 효소가 막혀 전사가 이루어지는 활성 부위에서 움직일 수 없게 되어버린다.
중합효소: 적인가 아군인가?
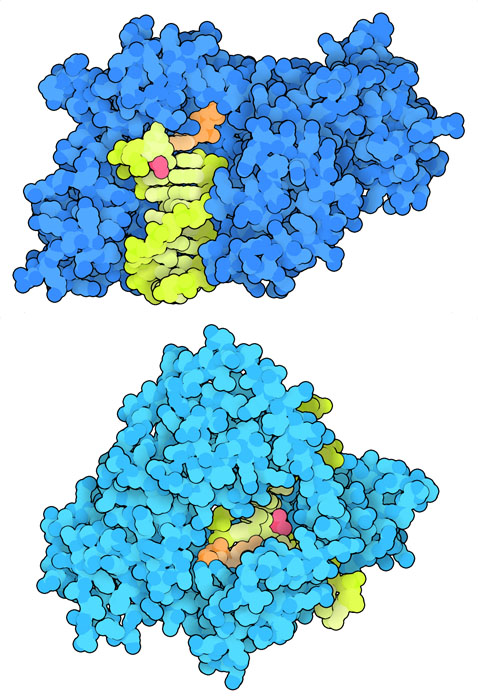
진핵생물은 시스플라틴 혹은 자외선에 의해 생긴 가교 등에 의해 손상된 DNA 손상 영역을 회피하는 특수 DNA 중합효소를 사용한다. 하지만 암세포는 시스플라틴에 대한 저항성을 획득해 이들 구조를 탈취할 수 있다. 한 예가 DNA 중합효소 η (에타, PDB 엔트리 2r8k)로 일반적으로는 자외선을 받은 세포가 살아남도록 돕는다. 암세포는 이 효소를 사용하여 가교가 만들어진 손상 영역을 극복하고 DNA를 복제하고 있는지도 모른다. DNA 중합효소 κ(카파, PDB 엔트리 6bs1)도 시스플라틴에 의한 DNA 손상 영역을 회피하는 데 도움이 되고 있을지도 모른다.
구조 보기
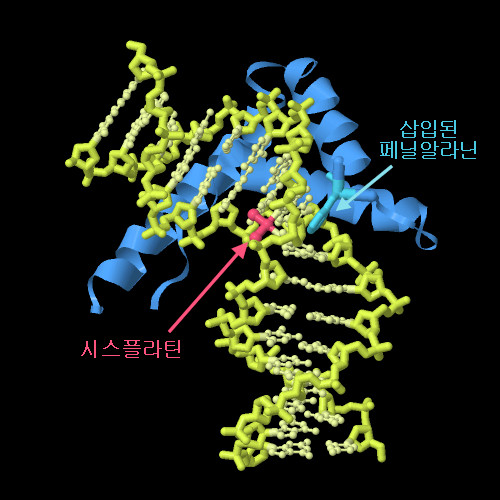
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
시스플라틴은 그 중심에 있는 플래티넘이 이웃한 2개의 구아닌 염기 사이에 공유결합을 만들어 DNA를 구부린다. PDB 엔트리 1ckt의 구조에는 짧은 DNA 이중 나선, 시스플라틴 손상 영역, 그리고 HMG 단백질의 DNA 결합 도메인이 포함된다. 또한 HMG 단백질도 결합할 때 DNA를 구부린다. HMG 단백질은 DNA 이중 나선인 시스플라틴에 의해 휘어진 부위에 페닐알라닌(하늘색)을 삽입하고 있다는 점에 주목하기 바란다. 또한 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 이미지로 전환한 후 이 구조를 보다 자세히 살펴보기 바란다.
이해를 높이기 위한 토픽
참고문헌
- 5djl 2019 A structure-based mechanism of cisplatin resistance mediated by Glutathione Transferase P1-1. Proc Natl Acad Sci U S A 116 13943-13951
- 6m97 2019 X-ray structures of the high-affinity copper transporter Ctr1. Nat Commun 10 1386-1386
- 6bs1 2018 Structural basis for human DNA polymerase kappa to bypass cisplatin intrastrand cross-link (Pt-GG) lesion as an efficient and accurate extender. J Mol Biol 430 1577-1589
- 5a39 2015 Structural insights into the recognition of cisplatin and Aaf-Dg lesion by Rad14 (Xpa). Proc Natl Acad Sci U S A 112 8272-8277
- 2014 Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol. 740 364-378
- 2012 Cisplatin resistance: a cellular self-defense mechanism resulting from multiple epigenetic and genetic changes. Pharmacol Rev 64 706–721
- 3lpv 2010 Structure of duplex DNA containing the cisplatin 1,2-Pt(NH(3))(2)(2+)-d(GpG) cross-link at 1.77A resolution. J Inorg Biochem 104 902-908
- 2r8k 2007 Bypass of DNA lesions generated during anticancer treatment with cisplatin by DNA polymerase eta. Science 318 967-970
- 2r7z 2007 Mechanism of transcriptional stalling at cisplatin-damaged DNA. Nat Struct Mol Biol 14 1127–1133
- 2001 Cisplatin: from DNA damage to cancer chemotherapy. Prog Nucl Acid Res Mol Biol 67 93-130
- 2007 The resurgence of platinum-based cancer chemotherapy. Nat Rev Cancer 7 573–584
- 1ckt
- 1995 Crystal structure of double-stranded DNA containing the major adduct of the anticancer drug cisplatin. Nature 377 649-652
- 3dnb 1991 Structure of the B-DNA decamer C-C-A-A-C-G-T-T-G-G and comparison with isomorphous decamers C-C-A-A-G-A-T-T-G-G and C-C-A-G-G-C-C-T-G-G. J Mol Biol 217 177-199
이 기사는 RCSB PDB의 PDB-101로 제공되고 있는 「Molecule of the Month」의.2021년3월의 기사를 한국어로 번역한 것입니다.전재·인용에 대해서는 이용 규약을 봐 주세요.


어린이들을위한
VR · 3D 안경
· 게임도 있습니다

일반 사람들을 위해
생체 고분자 학습


이달의 분자


VR 분자 뷰어
VR (가상 현실)이있는 분자 뷰어

요로즈미 프라임
생물학을 배우기 위한 생체분자 구조를 즐길 수 있는 웹 서비스!

종이 모델
종이로 단백질 분자 만들기

eProtS
PDB에 등록된 생체 고분자의 설명이 적힌 단백질 구조 백과사전

각종 자료
과거의 강습회나 이벤트의 자료

게임
신경 쇠약과 뱀 게임

COVID-19 정보
신형 코로나 바이러스 감염 (COVID-19) 정보

연락 문의처
PDBj
[일본 단백질구조 데이터 뱅크]
{
"header": {
"minimamHeightScale": 1.0,
"scalingAnimSec": 0.3
},
"src": {
"spacer": "/share/im/ui_spacer.png",
"dummy": "/share/im/ui_dummy.png"
},
"spacer": "/share/im/ui_spacer.png"
}