255: シスプラチンとDNA(Cisplatin and DNA)
驚くべき薬、シスプラチン
病気の治療率を5%から80%に上げる薬を想像してみて欲しい。シスプラチン(cisplatin)は2つのアミン(amine)と2つの塩化物イオン(chloride)にプラチナ(platinum)が結合した小さな分子で、まさにこの種の大きな変革をもたらした薬である。1970年代半ば、精巣がん(testicular cancer)の治療において非常に効果的であることがわかった。シスプラチンは鎖の中にある隣り合ったグアニン塩基(guanine base)をつなぐことにより、DNAに架橋をつくる。この架橋によってDNAは曲がり、通常の機能が妨げられて細胞とそのゲノムに損傷を与える。シスプラチンは精巣がんの外に、卵巣がん(ovarian cancer)や結合組織における腫瘍の治療にも使える薬としてFDAで最も初期に承認された薬の一つとなっている。
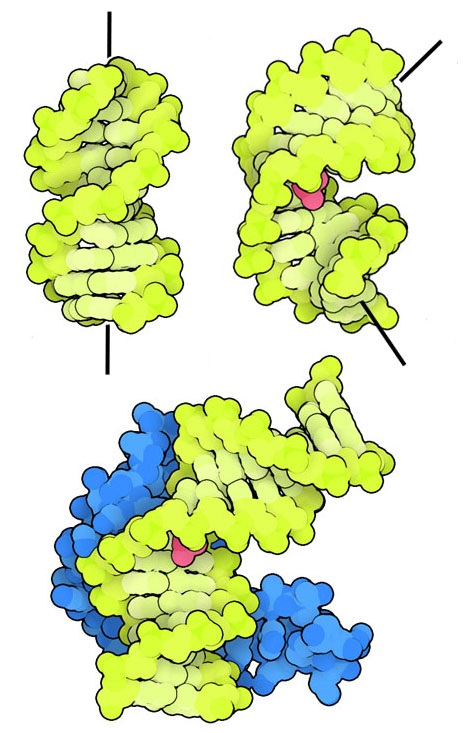
シスプラチンが働く様子
シスプラチンはDNAの配向を変化させ、それによりタンパク質とどのように相互作用するのかを変化させて細胞に影響をおよぼす。ここに示すように、通常のDNA(PDBエントリー3dnb)はまっすぐだが、シスプラチンが結合したDNA(PDBエントリー3lpv)は化学修飾部位で曲がっている。DNA結合ファミリーの中でも高い移動性を持つタンパク質群(high mobility group DNA-binding family、HMGドメインタンパク質)は曲がったDNAに結合することを好むため、PDBエントリー1cktで見られるように、曲がったシスプラチン結合DNAに結合するのである。そしてHMGタンパク質は、シスプラチンによって損傷したDNAを、DNAの複製、修復、転写に関係する他のタンパク質から保護する。これらの出来事が積み重なってアポトーシス(apoptosis、プログラム細胞死)が引き起こされる。
細胞は治療に抵抗する?
シスプラチンは何種類かのヒトのがんを治療するのに非常に効果的である。しかし、腫瘍はいくつかの方法でシスプラチン治療に対する抵抗性を発達させることがある。その方法には、細胞膜の内外を越えたシスプラチンの輸送を変化させ、細胞死を引き起こすしくみの働きを抑制するといった方法が含まれる。その抵抗性を克服し、さらに良く効いてより毒性が少ない薬を発見する上で、構造研究は重要である。例えば、シスプラチンと化学的に似たオキサリプラチン(oxaliplatin)は、シスプラチンに対する抵抗性を獲得したある種の腫瘍を治療するのに効果的であることがわかった。
混乱するタンパク質
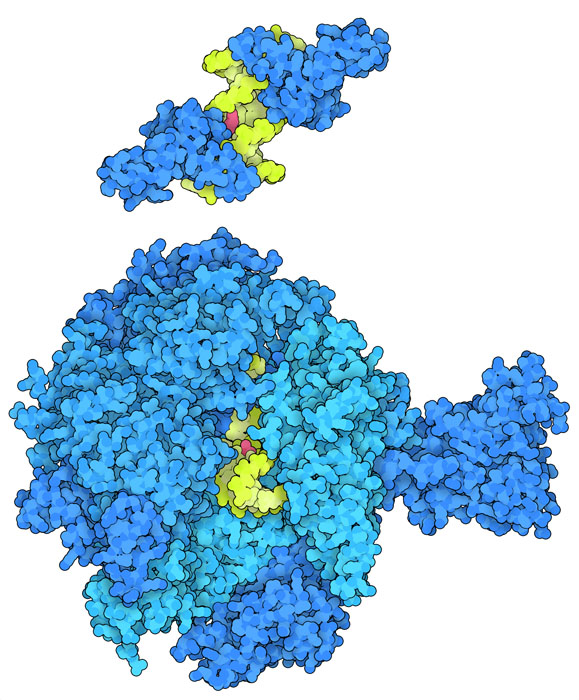
シスプラチンが結合したDNAは、DNAの修復と転写に関係するタンパク質が持つ通常の機能を低下させる。ヌクレオチド除去修復(nucleotide excision repair、NER)過程では、化学物質や放射線によってDNAにできた大きな異常部分(DNA損傷領域)を切り出して除去するのが一般的である。例えば、NERタンパク質の一種XPAは、損傷を受けたらせんの両側から曲がったDNAに結合する。その様子をPDBエントリー5a39で見ることができる。そしてXPAはDNAの両鎖にループを挿入し、この領域でDNA鎖を1本鎖に分離する。こうすることにより、他のNERタンパク質が結合し、DNA損傷領域全体を取り除くことができる。しかし、HMGタンパク質がシスプラチン-DNA複合体に結合するとこの防御が妨げられ、損傷が持続するようになるかもしれない。シスプラチンが結合したDNAは、細胞のDNAをRNAへと転写するRNAポリメラーゼII(RNA polymerase II、PDBエントリー2r7z)の働きも阻害するかもしれない。シスプラチンがDNAに結合すると、かさばる損傷領域で酵素が行き詰まり、転写が行われる活性部位から動けなくなってしまう。
ポリメラーゼ: 敵か味方か?
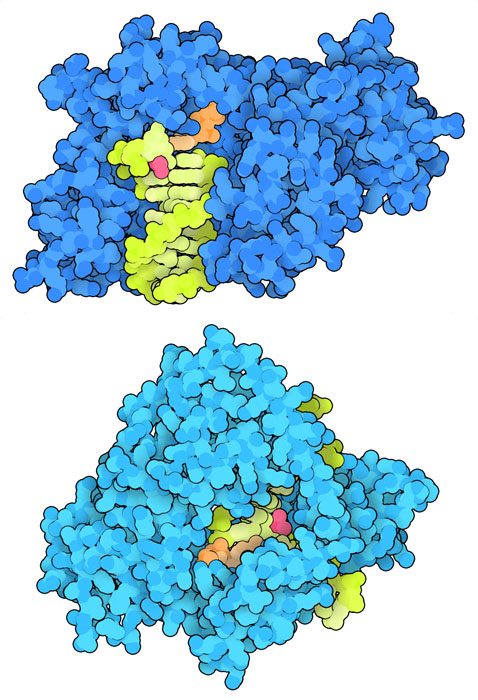
真核生物は、シスプラチンあるいは紫外線によってできた架橋などにより傷ついたDNA損傷領域を回避する特殊なDNAポリメラーゼを使う。しかし、がん細胞はシスプラチンに対する抵抗性を獲得しこれらのしくみを乗っ取ることができる。その一例がDNAポリメラーゼη(イータ、PDBエントリー2r8k)で、通常は紫外線を受けた細胞が生き残るのを助けている。がん細胞はこの酵素を使い、架橋された損傷領域を乗り越えてDNAを複製しているのかもしれない。DNAポリメラーゼκ(カッパ、PDBエントリー6bs1)もシスプラチンによるDNA損傷領域を回避するのに役立っているのかもしれない。
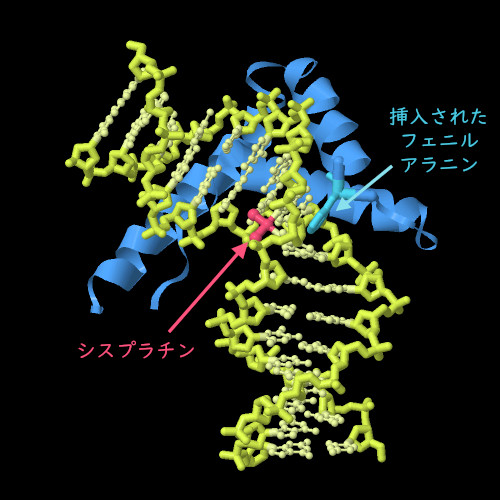
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
シスプラチンは、その中心にあるプラチナが隣り合った2つのグアニン塩基との間に共有結合をつくってDNAを曲げる。PDBエントリー1cktの構造には短いDNA二重らせん、シスプラチン損傷領域、そしてHMGタンパク質のDNA結合ドメインが含まれる。またHMGタンパク質も結合するときにDNAを曲げる。HMGタンパク質は、DNA二重らせんのシスプラチンによって曲げられた部位にフェニルアラニン(水色)を挿入していることに注目して欲しい。また図の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 5djl 2019 A structure-based mechanism of cisplatin resistance mediated by Glutathione Transferase P1-1. Proc Natl Acad Sci U S A 116 13943-13951
- 6m97 2019 X-ray structures of the high-affinity copper transporter Ctr1. Nat Commun 10 1386-1386
- 6bs1 2018 Structural basis for human DNA polymerase kappa to bypass cisplatin intrastrand cross-link (Pt-GG) lesion as an efficient and accurate extender. J Mol Biol 430 1577-1589
- 5a39 2015 Structural insights into the recognition of cisplatin and Aaf-Dg lesion by Rad14 (Xpa). Proc Natl Acad Sci U S A 112 8272-8277
- 2014 Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol. 740 364-378
- 2012 Cisplatin resistance: a cellular self-defense mechanism resulting from multiple epigenetic and genetic changes. Pharmacol Rev 64 706–721
- 3lpv 2010 Structure of duplex DNA containing the cisplatin 1,2-Pt(NH(3))(2)(2+)-d(GpG) cross-link at 1.77A resolution. J Inorg Biochem 104 902-908
- 2r8k 2007 Bypass of DNA lesions generated during anticancer treatment with cisplatin by DNA polymerase eta. Science 318 967-970
- 2r7z 2007 Mechanism of transcriptional stalling at cisplatin-damaged DNA. Nat Struct Mol Biol 14 1127–1133
- 2001 Cisplatin: from DNA damage to cancer chemotherapy. Prog Nucl Acid Res Mol Biol 67 93-130
- 2007 The resurgence of platinum-based cancer chemotherapy. Nat Rev Cancer 7 573–584
- 1ckt
- 1995 Crystal structure of double-stranded DNA containing the major adduct of the anticancer drug cisplatin. Nature 377 649-652
- 3dnb 1991 Structure of the B-DNA decamer C-C-A-A-C-G-T-T-G-G and comparison with isomorphous decamers C-C-A-A-G-A-T-T-G-G and C-C-A-G-G-C-C-T-G-G. J Mol Biol 217 177-199
この記事はRCSB PDBのPDB-101で提供されている「Molecule of the Month」の2021年3月の記事を日本語に訳したものです。転載・引用については利用規約をご覧ください。


こども向け
VR・3Dめがね
・ゲームもあるよ

一般向け
生体高分子の学習


今月の分子


VR分子ビューア
VR (バーチャルリアリティ) を備えた分子ビューア

よろづみプライム
生物学を学ぶための生体分子構造を楽しめるWebサービス!

ペーパーモデル
紙でタンパク質分子を作る

eProtS
PDBに登録された生体高分子の説明が書かれたタンパク質構造百科事典

各種資料
過去の講習会やイべントの資料

ゲーム
神経衰弱とスネークゲーム

COVID-19 情報
新型コロナウイルス感染症 (COVID-19) について

お問い合わせ
PDBj
[日本蛋白質構造データバンク]
{
"header": {
"minimamHeightScale": 1.0,
"scalingAnimSec": 0.3
},
"src": {
"spacer": "/share/im/ui_spacer.png",
"dummy": "/share/im/ui_dummy.png"
},
"spacer": "/share/im/ui_spacer.png"
}