12: ペプシン(Pepsin)
休日の楽しみ
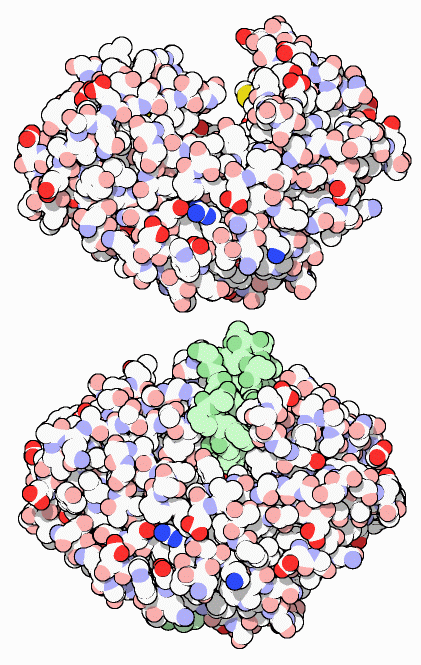
休みの季節になると、一年の他の時期よりもたくさんの要求を消化酵素に出すことが多い。私たちの消化機構には丈夫で安定な酵素が多く含まれている。これらは豊かな休日のごちそうを探しだして小さな断片へと分解するよう設計されている。ペプシン(pepsin)はタンパク質の消化を行う最初の酵素である。胃の中で、タンパク質鎖はペプシンの活性部位がある深い溝に結合し、小さな断片へと分解される。右図上の構造(PDBエントリー 5pep)にはその溝が示されている。そして、腸にある様々なタンパク質分解酵素(protease)やペプチド分解酵素(peptidase)がこの分解作業の仕上げを行う。最後に1、2個のアミノ酸となった小さな断片は細胞によって吸収され、代謝の燃料や新たなタンパク質の構築材料に使われる。
ややこしい仕事
タンパク質を消化する酵素は実に難しい課題をもたらす。酵素は細胞内で構築されるが、細胞自身のタンパク質をすぐに消化し始めることがないよう何らかの方法で制御されなければならない。この問題を解決するため、ペプシンおよびその他のタンパク質切断酵素は、不活性な「酵素前駆体」(proenzyme)として作られる。これは安全な細胞の外に出てから活性化される。ペプシンは右図下(PDBエントリー 3psg)に示すように、余分な44個のアミノ酸(緑の部分)がある状態で作られる。これは大きな活性部位の溝を塞ぎ、酵素の作用を妨げる。胃では、この余分な鎖は切断され、酵素は破壊的活動を開始する。
科学的歴史の一片
消化酵素はいくつかの理由から科学的研究にとって魅力的な候補となっている。まず、簡単に単離できて消化液中に豊富に存在している。また、消化機構中の過酷な環境下で仕事を行うため、非常に安定である。更に、消化機構によって触媒される反応は簡単に追跡できる。ゼラチン(gelatin)などのタンパク質を加え、そのゲル状の堅さがが失われるのを観察すればよい。ペプシンは、18世紀に最初の酵素として発見され、その後2番目に結晶化された酵素となった(最初に結晶化された酵素はウレアーゼ(urease)である)。これらの結晶は、酵素がタンパク質であり明確な構造を持っていることを示すのに重要な役割を果たした。今日、同じような結晶から決定されたペプシンの構造が、PDBエントリー 5pepなどで利用できる。
酸タンパク質分解酵素
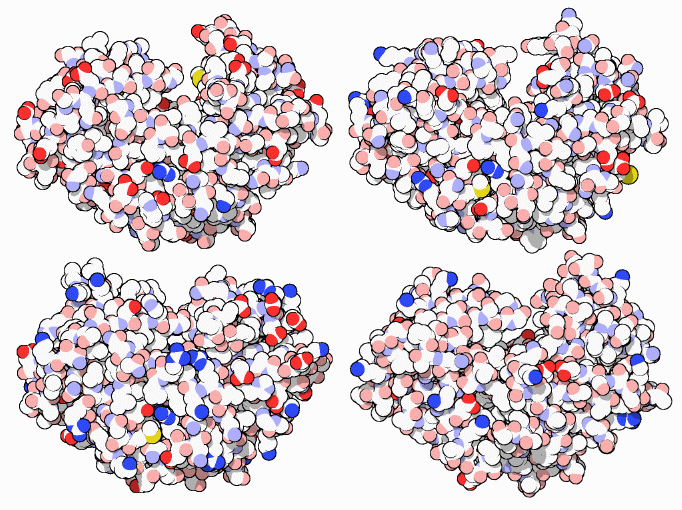
ペプシンは「酸タンパク質分解酵素」(acid protease、酸プロテアーゼ)と呼ばれる酵素群の一例である。ペプシンの場合、この名前は二重の意味で妥当なものとなっている。ペプシンは強い塩酸(hydrochloric acid)の中で最も良く働く。ところが、上図に示す他の類似酵素との共通点としての「酸」は、別の型の酸のことを指している。酸タンパク質分解酵素の活性部位は、酸性アミノ酸のアスパラギン酸(aspartate)2つに依存している。これらは水分子を活性化し、タンパク質鎖を切断するのに使う。共通点としての「酸」はこちらのことを言っているのである。なお、これらのアスパラギン酸は後ほど詳しく見ることにする。
酸タンパク質分解酵素は、異なる生物における何種類かの役割を満たすよう進化してきた。左上に示したペプシン(PDBエントリー 5pep)は、胃の中の酸性環境下で食物を消化するよう最適化された。これは非常にでたらめな酵素で、タンパク質を様々な長さの断片に切断する。右上に示したキモシン(chymosin、PDBエントリー 4cms)は若い子牛が牛乳のタンパク質を分解するために作る。子牛の胃から得られたキモシンを精製したものは、チーズの製造過程で牛乳を凝固させるのに何百年も使われてきた。左下のカテプシンD(cathepsin D、PDBエントリー 1lyb)は、細胞内にある小さな胃、リソソーム(lysozome)の中でタンパク質を分解する。レニン(renin、PDBエントリー 1hrn、ここには図示していない)など別の細胞性酸タンパク質分解酵素は、ある特定のタンパク質の非常に特定された場所を切断するよう設計されている。これはホルモンや構造タンパク質の成熟を助ける。右下のエンドシアペプシン(Endothiapepsin、PDBエントリー 4ape)は菌類(fungus)によって作られ周辺環境へ放出される。これが周辺のタンパク質を分解し、できた断片を菌類が食べられるようになる。
構造をみる
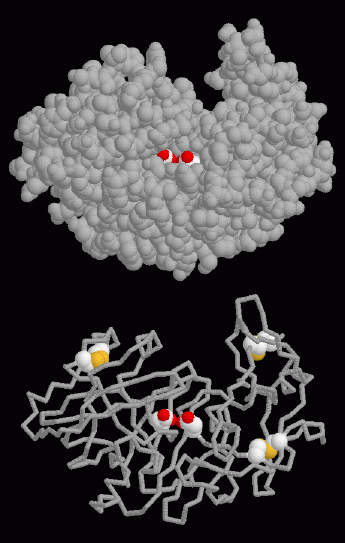
ペプシンはタンパク質切断反応を行うのに1組のアスパラギン酸残基を使う。平行進化(parallel evolution、2つの生物が独立にある問題を解決するための同じ方法を発展させること)の一例として、同じような機構が以前紹介したHIVタンパク質分解酵素でも見られる。右図上に示したのはPDBエントリー 5pepの構造で、活性部位のアスパラギン酸が中央の深い活性部位の溝の中に白と赤の球で表示されている。右図下に示したのは、3つのジスルフィド結合も合わせて表示したものである。システイン(cysteine)アミノ酸の硫黄原子(sulfur atom、黄)相互間に形成された結合が、タンパク質鎖をより強固なものにしている。
活性部位のアスパラギン酸を強調するには、この構造中の32番と215番の残基を選択してください。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









