6: HIV-1タンパク質分解酵素(HIV-1 Protease)
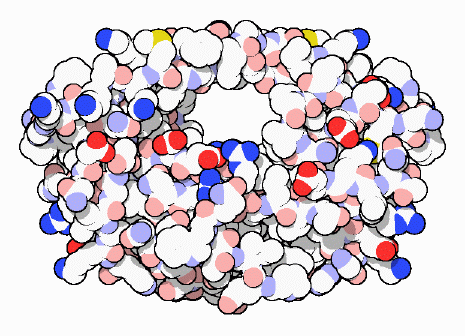
AIDS治療の標的
HIV-1タンパク質分解酵素(HIV-1 protease)を攻撃する薬は現代医学における大いなる成功の1つである。AIDS(後天性免疫不全症候群)感染症はわずか数十年前に始まったばかりで、それ以前にHIV(ヒト免疫不全ウイルス)は知られていなかった。これらの薬は、医学が新たな病気に立ち向かう際の強力な道具であることが明らかになっている。既に研究者たちは、ウイルスの成長を遅らせ停止させる効果的な薬を発見している。ところが重大な問題がまだ残っている。特に、HIVに対する効果的なワクチン(vaccine)がまだないのである。しかし今日、HIVに感染した患者には強力な治療法がある。
HIVへの攻撃
HIV-1タンパク質分解酵素は、HIVの生活環において欠かせない段階を進めている酵素である。HIVも他の多くのウイルスと同様に、多くのタンパク質をいくつか他のタンパク質をつないだ1本の長い鎖として作る。HIV-1タンパク質分解酵素は、この長い「ポリタンパク質」(polyprotein)を個々のタンパク質へと切断する役割を担っている。この段階は実行するタイミングが重要である。不活性型であるポリタンパク質は、ウイルスの未成熟型として集まっている生活環の初期段階で必要である。そして、新たな細胞へ感染する時には、ポリタンパク質が適切な断片へと切断され成熟型ウイルスが形成される必要がある。切断反応は適切な時期ぴったりに行われ、ポリタンパク質が分解される前に未成熟ウイルスが適切に集合できるようにしなければならない。この機能は敏感で欠かせないものであるため、HIV-1タンパク質分解酵素は薬剤治療における絶好の標的となる。薬剤分子はタンパク質分解酵素に強く結合して活動を阻害し、それによりウイルスは死滅してしまう。なぜなら、ウイルスは感染性のある成熟型に変換できなくなるからである。
綿密に調査された酵素
HIV-1タンパク質分解酵素の原子構造はHIV薬開発において多くのことを可能にした。最初の構造は1989年に報告された。その後10年が経って、いくつかの遺伝種に由来する酵素、様々な他の薬剤や阻害剤と複合体を形成している酵素、何十種類もの変異体酵素を含む百種類以上の構造がPDBデータベースで利用できるようになった。更に何百種類もの構造が製薬会社内部のデータベースに登録されている。これらは新薬候補の試験と改良に利用されている。HIV-1タンパク質分解酵素は全体として、医学で知られている現在もっとも良く研究されている酵素の1つである。しかしこの酵素は不思議な酵素で、まだ数々の秘密を秘めている。
小さいが効果的な酵素
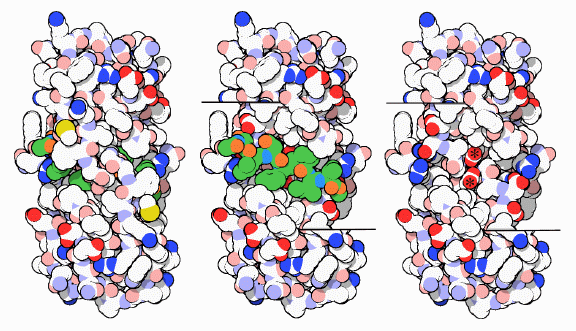
HIV-1タンパク質分解酵素は小さな酵素で、同じタンパク質鎖が2つ集まってできている。それぞれの鎖を構成するアミノ酸はたったの99個である。この2つの鎖が集まって長いトンネルを構成し、図の両側面に見える口を2つの柔軟なタンパク質が覆って「ふた」をしている。ふたが開くと、酵素は分解するタンパク質鎖を包み込んでトンネルの中に近づけ、強くつかむ。活性部位はトンネルの中央にあり、そこで水分子を使ってタンパク質鎖の分解が行われる。上図は酵素(PDBエントリー 7hvp)を上から見たものである。右と中央の図では、活性部位が見えるようふたを除去してある。中央の図では、本来タンパク質鎖が来る場所付近に阻害剤(緑)が位置している様子が示されている。(活性型のHIV-1タンパク質分解酵素に結合したポリタンパク質の構造はPDBに登録されていない。なぜなら構造を解く前にポリタンパク質が分解されてしまうのだから! したがって、阻害剤がどのように結合するかを見て酵素がどのようにポリタンパク質に結合するのかを想像する必要がある。)どのようにして、阻害剤の鎖が活性部位でまっすぐ引き延ばされているのかに注目して欲しい。上図右では活性部位が見えるように阻害剤も除去してある。アスタリスク(*)で示した2つのアスパラギン酸(aspartate)アミノ酸が、タンパク質鎖のど真ん中を攻撃する仕事を全てこなす。
構造をみる
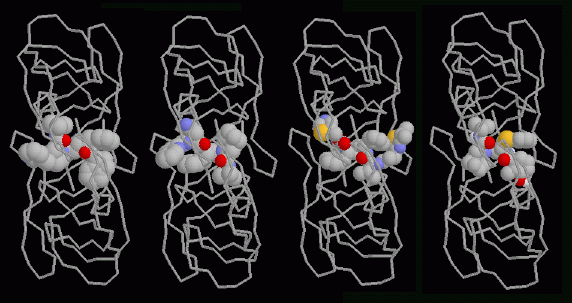
HIV-1タンパク質分解酵素を攻撃する4種類の薬がHIV感染者の治療に用いられている。この4種類の薬全てについて、HIV-1タンパク質分解酵素に結合した構造がPDBに登録されている。上図は、2本のタンパク質鎖でできた酵素は主鎖(backbone)表現で、薬の分子は空間充填(spacefill)表現で示したものである。図は上から見たものだが、ここで「ふた」がどのようにして薬分子を覆っているのかに注目して欲しい。薬は左から順に、インジナビル(indinavir、PDBエントリー 1hsg)、サキナビル(saquinavir、PDBエントリー 1hxb)、リトナビル(ritonavir、PDBエントリー 1hxw)、ネルフィナビル(nelfinavir、PDBエントリー 1ohr)である。これらの薬はどれも似ていることに注目して欲しい。いずれも炭素が豊富な官能基が分子の両側に並んでいて、活性部位のあるトンネルの側面と相互作用する。また中央には2つの酸素原子(各図中央付近に赤で示した原子)があり、通常は「ふた」の下に捕らえられる特別な水分子(図には示されていない)と相互作用する。どの薬も、酵素によって切断されるタンパク質鎖とよく似ていて、同じように酵素と結合するが、タンパク質鎖よりも更に安定である。そのためHIV-1タンパク質分解酵素は薬を切断することができず、薬は活性部位に留まり続けて酵素の通常の機能を阻害する。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









